-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
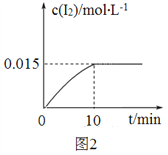
(1)砷的常见氧化物有 As2O3 和 As2O5,其中 As2O5 热稳定性差。根据图 1 写出 As2O5 分解为 As2O3 的热化学方程式_________________。
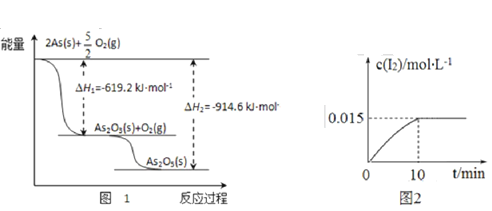
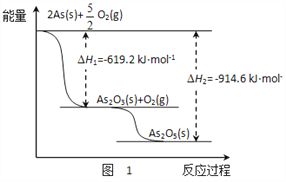
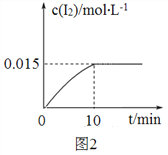
(2)砷酸钠具有氧化性,298 K 时,在 100 mL 烧杯中加入 10 mL 0.1 mol/L Na3AsO4 溶液、20 mL 0.1 mol/L KI 溶液和 20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+  AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中 c(I2)与时间(t)的关系如图 2 所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中 c(I2)与时间(t)的关系如图 2 所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于 I2 的生成速率 d. 保持不再变化
保持不再变化
②0~10 min 内,I−的反应速率 v(I−)=_______。
③在该条件下,上述反应的平衡常数 K=______。
④升高温度,溶液中 AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)雄黄(As4S4)在空气中加热至 300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3), 另一种氧化物为______(填化学式),可用双氧水将 As2O3 氧化为 H3AsO4 而除去,写出该反应的化学方 程式_________。
-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。
(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). 由图1可知,As2O3(s)和O2(g)反应转化为As2O5(s)的△H=-(914.6-619.2)kJ/mol=-295.4kJ/mol,则热化学方程式为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol,故答案为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol;
(2). ①. 升高温变,溶液中AsO43-的平衡转化率减小,说明升高温度,平衡逆向移动,该反应为放热反应,则△H<0,故答案为:小于;
②. 在0~10min 内,I2的浓度从0变为0.015mol/L,由反应方程式可知,I-减少了0.03mol/L,则0~10min 内,用I-表示的反应速率v(I-)=0.03mol/L÷10min=0.003mol/(L·min),故答案为:0.003mol/(L·min);
③. a. 根据物料守恒关系可知,溶液中的c(AsO33-)+c(AsO43-)始终不变,所以c(AsO33-)+c(AsO43-)不再变化,不能说明反应达到平衡状态,故a错误;b. 溶液颜色不再变化,说明各物质的浓度不再改变,反应达到平衡状态,故b正确;c. c(AsO33-)与c(AsO43-)的比值不再变化,说明正逆反应速率相等,反应达到平衡状态,故c正确;d. I-的生成速率等于I2的生成速率,正逆反应速率不相等,说明反应没有达到平衡状态,故d错误;答案选:bc;
④. 由反应方程式可知,在该条件下,反应平衡常数的表达式K= ,故答案为:
,故答案为: ;
;
(3). ①. 用0.02500mol/L的I2溶液滴定含AsO33-和AsO43-的混合溶液,当滴入最后一滴标准液时,溶液由无色变蓝色,且30s内不恢复,即为滴定终点,上述混合液用0.02500mol/L的I2溶液滴定,重复滴定3次,平均消耗I2溶液40.0mL,根据As2O5+6OH−=2AsO43−+3H2O、AsO33-+I2+H2O  AsO43-+2I-+2H+可知:
AsO43-+2I-+2H+可知:
1 1
n 0.02500mol/L×0.04L,n(AsO33-)= 0.001mol,则试样中As2O5的质量分数是 ×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
【题型】综合题
【结束】
11
元素周期表中第四周期元素有许多重要用途。
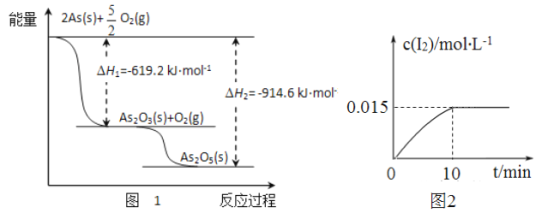
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。
-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
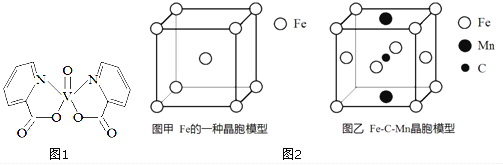
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。
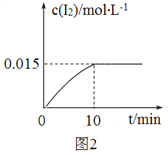
(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。
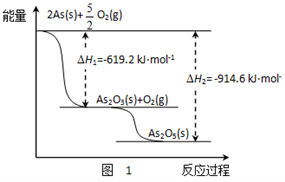
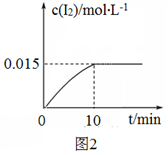
(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式________________________。
-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。

(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。

(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
【答案】 略 略 略 略 略 略 略 略
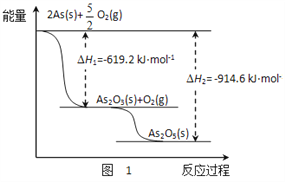
【解析】(1). 由图1可知,As2O3(s)和O2(g)反应转化为As2O5(s)的△H=-(914.6-619.2)kJ/mol=-295.4kJ/mol,则热化学方程式为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol,故答案为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol;
(2). ①. 升高温变,溶液中AsO43-的平衡转化率减小,说明升高温度,平衡逆向移动,该反应为放热反应,则△H<0,故答案为:小于;
②. 在0~10min 内,I2的浓度从0变为0.015mol/L,由反应方程式可知,I-减少了0.03mol/L,则0~10min 内,用I-表示的反应速率v(I-)=0.03mol/L÷10min=0.003mol/(L·min),故答案为:0.003mol/(L·min);
③. a. 根据物料守恒关系可知,溶液中的c(AsO33-)+c(AsO43-)始终不变,所以c(AsO33-)+c(AsO43-)不再变化,不能说明反应达到平衡状态,故a错误;b. 溶液颜色不再变化,说明各物质的浓度不再改变,反应达到平衡状态,故b正确;c. c(AsO33-)与c(AsO43-)的比值不再变化,说明正逆反应速率相等,反应达到平衡状态,故c正确;d. I-的生成速率等于I2的生成速率,正逆反应速率不相等,说明反应没有达到平衡状态,故d错误;答案选:bc;
④. 由反应方程式可知,在该条件下,反应平衡常数的表达式K= ,故答案为:
,故答案为: ;
;
(3). ①. 用0.02500mol/L的I2溶液滴定含AsO33-和AsO43-的混合溶液,当滴入最后一滴标准液时,溶液由无色变蓝色,且30s内不恢复,即为滴定终点,上述混合液用0.02500mol/L的I2溶液滴定,重复滴定3次,平均消耗I2溶液40.0mL,根据As2O5+6OH−=2AsO43−+3H2O、AsO33-+I2+H2O  AsO43-+2I-+2H+可知:
AsO43-+2I-+2H+可知:
1 1
n 0.02500mol/L×0.04L,n(AsO33-)= 0.001mol,则试样中As2O5的质量分数是 ×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
【题型】综合题
【结束】
11
元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。

-
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式________________________。

-
(14分)砷(As)广泛分布于自然界,其原子结构示意图是 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。

(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+  AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。

① A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针 (填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
-
(14分)砷(As)广泛分布于自然界,其原子结构示意图是 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。

(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+  AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。

①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应是 。
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针______(填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。
As2O5与NaOH溶液反应的离子方程式是 。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
-
砷(33As)在周期表中与氮同主族,砷及其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷化氢的电子式为_________。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式_____________________。
(3)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式________________________________________。
(4)砷酸钠(Na3AsO4)具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①0~10 min内,I−的反应速率v(I−)=______________。
②在该条件下,上述反应的平衡常数K=__________。
③升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(5)己知砷酸(H3ASO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c(HAsO42-)___c(H3AsO4)(填“>”、“<”或“=”)。
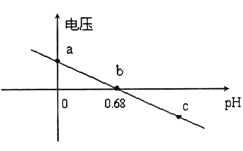
②某实验小组依据反应AsO43-+2H++2I-⇌AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图。则a点时,盐桥中K+____移动(填“向左”、“向右”或“不”),c点时,负极的电极反应为____________________。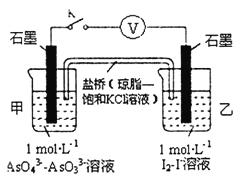


AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
保持不再变化




















