-
(8分)某研究性学习小组为探究纯铁与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
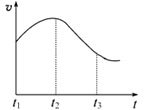
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是________ ,t2~t3速率变化的主要原因是________。
(2)若要加快化学反应速率,除实验②的方法外,还可以采取哪些措施?(至少写两点)
________ 、 ________
(3)某同学认为实验②反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
________(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:________
b、若正确则写出实验②中原电池的正、负极电极反应式。________
(4)已知热化学方程式Fe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)↑ ; △H= —42kJ/mol,28g的铁完全反应后放出的热量为________。
-
(10分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
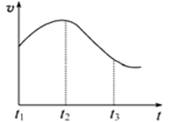
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原是,t2~t3速率变化的主要原因是________。
(2)实验②放出氢气的量减少的原因是(用离子方程式表示)________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
________(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式:_________________________
-
(6分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是,
t2~t3速率变化的主要原因是。
(2)实验②放出氢气的量减少的原因是。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
________(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a.若不正确,请说明原因:________
b.若正确则写出实验③中原电池的正、负极电极反应式。 ________
-
Ⅰ、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是_____________。
(2)实验②放出氢气的量减少的原因是_____________。(用离子方程式表示)
(3)实验③反应速率加快的主要原因是___________。
II、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
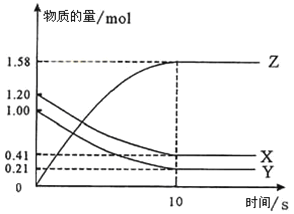
(1)写出该反应的化学方程式_______________。
(2)反应开始到10s,用X表示的反应速率是__________。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
a. 当X与Y的反应速率之比为1:1
b. 混合气体中X的质量分数保持不变
c. X、Y、Z的浓度之比为1:1:2
-
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:

实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是________。
(2)实验二放出氢气量减少的原因是________。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
-
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中 与盐酸反应最剧烈, 与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强。反应的离子方程式为 。
Ⅱ.利用下图装置来验证同主族元素非金属性的变化规律:
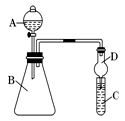
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明。干燥管D的作用是 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中 的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 。因此应在B、D之间增加一个盛有足量 (选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是 。
-
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中 与盐酸反应最剧烈, 与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强。反应的离子方程式为 。
Ⅱ.利用下图装置来验证同主族元素非金属性的变化规律:
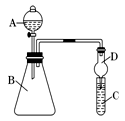
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明。干燥管D的作用是 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中 的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 。因此应在B、D之间增加一个盛有足量 (选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是 。
-
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____与盐酸反应最剧烈,_____与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明。干燥管D的作用是_________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________。
-
某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素。
该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究 、 对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明 ,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是 和 ,实验结论是 ;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:
。
-
某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.
该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究 、 对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明 ,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是 和 ,实验结论是 ;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响: .





