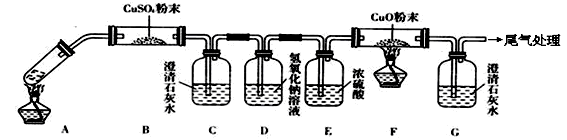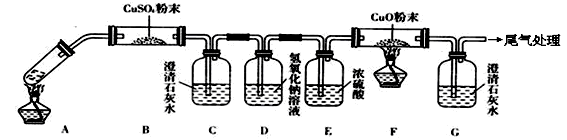-
(16分)某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________________。
(2)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
①该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是_______ _ ______。
②请配平该反应的离子方程式:______MnO4-+____H2C2O4+____ ===____Mn2++____CO2↑+____。
(3)为了探究草酸的不稳定性,某同学设计了如下实验装置:
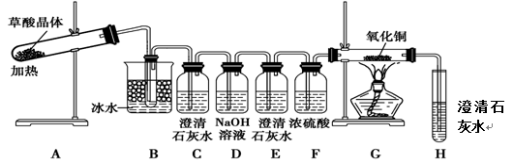
①C、H装置均变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式: 。
②上述装置中,B装置的作用是 。 D的作用是 。从环境保护角度来看,该方案的不足之处是 。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为_______________(用离子符号表示)。
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
_____MnO4-+_____H2C2O4+____H+ = ____Mn2++_____CO2+____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是______。乙二酸分解的化学方程式为__________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2 H2O)加入到100mL0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单描述)。
(5)以上溶液中各离子的浓度由大到小的顺序为:_________(用离子符号表示)。
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为____________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有_______(填:“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:__MnO4-+__H2C2O4+__H+=__Mn2++__CO2↑+__H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
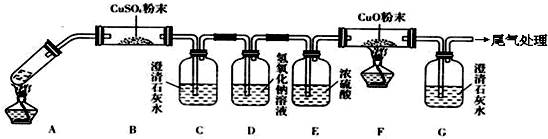
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是____________________。乙二酸分解的化学方程式为________________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________。
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:__________________。
(6)设计实验证明草酸的酸性比碳酸强:__________________ 。
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:
______ MnO4-+______ H2C2O4+______ H+=______ Mn2++______ CO2↑+______H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
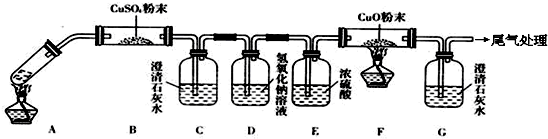
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红.据此回答:
①上述装置中,D的作用是______,
②乙二酸分解的化学方程式为______ H2O+CO↑+CO2↑
-
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4–+ ____ H2C2O4+ ____ H+  ____ Mn2++ ____CO2↑ + ____ H2O
____ Mn2++ ____CO2↑ + ____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
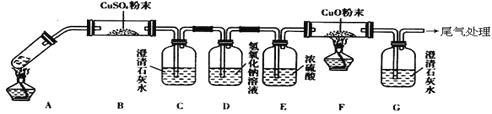
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末由黑色变为红色。据此回答:
上述装置中,D的作用是__________________.乙二酸分解的化学方程式为______________________________________.
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________(用文字简单表述)。
(5)以上溶液中各离子的浓度由大到小的顺序为_________(用离子符号表示)。
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
_____MnO4-+_____H2C2O4+____H+ = ____Mn2++_____CO2+____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
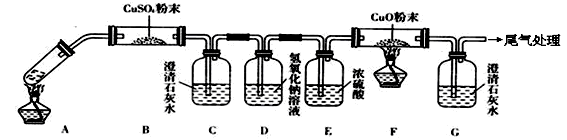
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是______。乙二酸分解的化学方程式为__________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2 H2O)加入到100mL0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单描述)。
(5)以上溶液中各离子的浓度由大到小的顺序为:_________(用离子符号表示)。
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为__________________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。
乙二酸分解的化学方程式为_____________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是__________________。(用文字简单表述)
(5)以上溶液中各离子的浓度由大到小的顺序为:_____________________________;(用离子符号表示)
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
⑴向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为________________________________。
⑵向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
⑶将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。乙二酸分解的化学方程式为______________________。
⑷该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________________________(用文字简单表述)。
⑸以上溶液中各离子的浓度由大到小的顺序为:_____________________________(用离子符号表示);
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
_____MnO4-+_____H2C2O4+____H+ = ____Mn2++_____CO2+____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
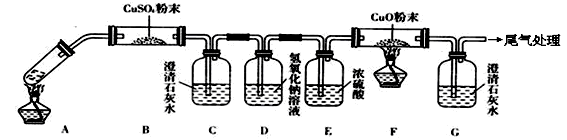
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是______。乙二酸分解的化学方程式为__________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2 H2O)加入到100mL0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单描述)。
(5)以上溶液中各离子的浓度由大到小的顺序为:_________(用离子符号表示)。
-
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:
______ MnO4-+______ H2C2O4+______ H+=______ Mn2++______ CO2↑+______H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红.据此回答:
①上述装置中,D的作用是______,
②乙二酸分解的化学方程式为______ H2O+CO↑+CO2↑