-
(14分)CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+ = 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I- = 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
高三化学简答题极难题查看答案及解析
-
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L—1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
相关反应离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+ = 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I- = 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1) 已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1;
(2) MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
高三化学实验题极难题查看答案及解析
-
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 ml。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml。
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1. 27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。该反应的离子方程式为 。
若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
高三化学实验题简单题查看答案及解析
-
CuSO4溶液与K2C2O4溶液棍合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mlKMnO4溶液。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml Na2S2O3溶液。已知涉及的部分反应的离子方程式为:
I2+2S2O32-=2I+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu )≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。写出该反应的离子方程式为 若无此加热操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b中第一步反应的方程式为 ,若用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。(请写出计算过程)
高三化学实验题困难题查看答案及解析
-
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为________。
(2)步骤④中加入的指示剂为________。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
高三化学计算题中等难度题查看答案及解析
-
(2015秋•上海校级月考)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4•5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2,反应中固体完全溶解,两种酸均恰好完全反应.设固体混合物的总质量为480g,其中铜屑的质量分数为0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4•5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
高三化学计算题困难题查看答案及解析
-
某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4•5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2,反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480g,其中铜屑的质量分数为0.400,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4•5H2O,试求(1)混酸中HNO3 与H2SO4的物质的量之比为:___________;(2)原混酸中H2SO4 的质量分数__________。
高三化学计算题困难题查看答案及解析
-
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知: KMnO4+ H2C2O4+ H2SO4= MnSO4+ K2SO4+ CO2+ H2O
(1) 配平上述反应方程式
(2) 草酸为二元弱酸,其一级电离的方程式为 。
(3)滴定终点观察到的现象为 。
(4)通过计算确定样品的组成(写出计算过程)。
高三化学填空题中等难度题查看答案及解析
-
某实验室采用新型合成技术,以Cu(CH3COO)·2H2O和K2C2O4·H2O为原料在玛瑙研钵中研磨反应,经过后处理得到蓝色晶体。已知该蓝色晶体的化学式为Ka[Cub(C2O4)c]·nH2O,在合成过程中各种元素的化合价均不发生变化。为了测定其组成进行以下两组实验,请回答相关问题:
Ⅰ.草酸根与铜含量的测定
①将蓝色晶体于研钵中研碎,取该固体粉末,加入1mol/L的H2SO4溶解,配制成250mL溶液。
②配制100mL0.1000mol/LKMnO4溶液备用。
③取所配溶液25.00mL于锥形瓶中,采用0.1000mol/LKMnO4溶液滴定至草酸根恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
④另取所配溶液25.00mL于锥形瓶中,加入过量KI溶液,充分反应后用0.2000mol/LNa2S2O3溶液滴定,消耗12.50mL.(发生反应:2Cu2++4I-=2CuI↓+I2,2Na2S2O3+I2=Na2S4O6 + 2NaI)
(1)后处理提纯该蓝色晶体时,除掉的杂质的主要成分 (除原料外)是_______(填化学式)
(2)配制0.1000mol/LKMnO4溶液,需要的玻璃仪器有________、_______,胶头滴管,玻璃棒,烧杯。
(3)用Na2S2O3滴定时,应选用_______滴定管(填“酸式”或“碱式”)
(4)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为_______,滴定终点的现象为_____。
Ⅱ.热重分析法测定结晶的含量

氮气气氛中以升温速率10℃/min测定该化合物的热失重曲线,如图所示晶体在107℃失重10.2%,失去全部结晶水。
(5)通过热失重分析,蓝色晶体的化学式中n=________,经过实验测定后,蓝色晶体的化学式为________.
(6)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为________。
高三化学实验题困难题查看答案及解析
-
某固体混合物X中可能含有FeO、
、
、
、
、
、
、KI、
中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:

已知:
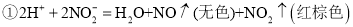
在酸性环境下具有较强的氧化性
无色,不溶于水且不与碱溶液反应
根据上述实验,下列说法中不正确的是
A.X中一定含有
、
和
B.X中一定没有
和KI,可能含有
和
C.X中至少有FeO、
中的一种
D.气体A一定含有
、
和
高三化学单选题困难题查看答案及解析