-
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为________。
(2)步骤④中加入的指示剂为________。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
高三化学计算题中等难度题查看答案及解析
-
(14分)CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+ = 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I- = 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
高三化学简答题极难题查看答案及解析
-
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L—1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
相关反应离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+ = 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I- = 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1) 已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1;
(2) MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
高三化学实验题极难题查看答案及解析
-
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 ml。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml。
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1. 27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。该反应的离子方程式为 。
若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
高三化学实验题简单题查看答案及解析
-
CuSO4溶液与K2C2O4溶液棍合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mlKMnO4溶液。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml Na2S2O3溶液。已知涉及的部分反应的离子方程式为:
I2+2S2O32-=2I+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu )≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。写出该反应的离子方程式为 若无此加热操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b中第一步反应的方程式为 ,若用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。(请写出计算过程)
高三化学实验题困难题查看答案及解析
-
某实验室采用新型合成技术,以Cu(CH3COO)·2H2O和K2C2O4·H2O为原料在玛瑙研钵中研磨反应,经过后处理得到蓝色晶体。已知该蓝色晶体的化学式为Ka[Cub(C2O4)c]·nH2O,在合成过程中各种元素的化合价均不发生变化。为了测定其组成进行以下两组实验,请回答相关问题:
Ⅰ.草酸根与铜含量的测定
①将蓝色晶体于研钵中研碎,取该固体粉末,加入1mol/L的H2SO4溶解,配制成250mL溶液。
②配制100mL0.1000mol/LKMnO4溶液备用。
③取所配溶液25.00mL于锥形瓶中,采用0.1000mol/LKMnO4溶液滴定至草酸根恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
④另取所配溶液25.00mL于锥形瓶中,加入过量KI溶液,充分反应后用0.2000mol/LNa2S2O3溶液滴定,消耗12.50mL.(发生反应:2Cu2++4I-=2CuI↓+I2,2Na2S2O3+I2=Na2S4O6 + 2NaI)
(1)后处理提纯该蓝色晶体时,除掉的杂质的主要成分 (除原料外)是_______(填化学式)
(2)配制0.1000mol/LKMnO4溶液,需要的玻璃仪器有________、_______,胶头滴管,玻璃棒,烧杯。
(3)用Na2S2O3滴定时,应选用_______滴定管(填“酸式”或“碱式”)
(4)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为_______,滴定终点的现象为_____。
Ⅱ.热重分析法测定结晶的含量

氮气气氛中以升温速率10℃/min测定该化合物的热失重曲线,如图所示晶体在107℃失重10.2%,失去全部结晶水。
(5)通过热失重分析,蓝色晶体的化学式中n=________,经过实验测定后,蓝色晶体的化学式为________.
(6)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为________。
高三化学实验题困难题查看答案及解析
-
(14分)室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定该沉淀的组成,某研究性学习小组进行了以下实验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:________。
(二)【理论探究】
假设二中只生成Cu(OH)2的原因是________ (用一个离子方程式表示)。
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
(三)【实验探究】
步骤一:将CuSO4溶液加入到等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来。
步骤三:利用下图所示装置,选择必要的试剂,定性探究生成物的成分。
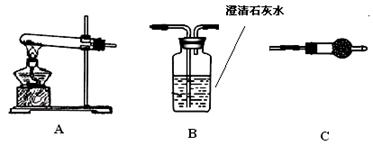
(1)各装置连接顺序为 ________ 。
(2)装置C中装有试剂的名称是________。
(3)能证明生成物中有CuCO3的实验现象是________。
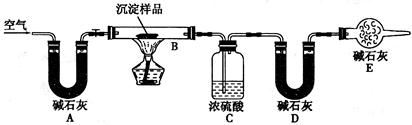
步骤四: 步骤三:利用下图所示装置,进行定量分析:
(4)①A装置中玻璃仪器的名称是________。
②实验开始时和实验结束时都要通入过量的空气其作用分别是________
________和________。
数据记录:
B装置中样品的质量(g)
C装置的质量(g)
D装置的质量(g)
实验前
33.3
262.1
223.8
试验后
24
264.8
230.4
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,若所得沉淀是纯净物而不是混合物,通过计算写出该物质的化学式________。
高三化学实验题中等难度题查看答案及解析
-
室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:________;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设________是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②________,③干燥。
步骤三:利用下图所示装置,进行定量分析:
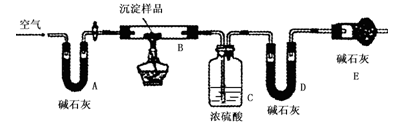
① A装置中玻璃仪器的名称是________。
② 仪器组装好后首先要进行的实验操作是。
③ 实验结束时通入过量的空气的作用是 ________。
④ 数据记录:
B装置的质量(g)
C装置的质量(g)
D装置的质量(g)
实验前
15.4
262.1
223.8
试验后
6.1
264.8
230.4
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为________。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式。
高三化学填空题中等难度题查看答案及解析
-
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验。
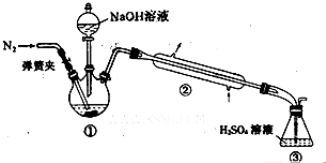
Ⅰ.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温后,称重,质量为5.68g。
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入氮气,用40.00mL 1mol•L-1的硫酸溶液吸收产生氨气。蒸氨结束后取下接收瓶,用2mol•L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液。
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的物质全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6g。回答下列问题:
(1)在实验I中,不可能用到的实验仪器是________(填正确答案标号)
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是____________。
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用______式滴定管;可使用的指示剂为_______;若在滴加氢氧化钠溶液时有少量待测液溅出,会使测量值________。
(4)在实验中,检验沉淀是否洗净的方法是________________。
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为_____________,三颈瓶中发生反应的离子方程式为_________。
高三化学实验题极难题查看答案及解析
-
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知: KMnO4+ H2C2O4+ H2SO4= MnSO4+ K2SO4+ CO2+ H2O
(1) 配平上述反应方程式
(2) 草酸为二元弱酸,其一级电离的方程式为 。
(3)滴定终点观察到的现象为 。
(4)通过计算确定样品的组成(写出计算过程)。
高三化学填空题中等难度题查看答案及解析