-
(13分)
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
(1)写出元素E基态原子的电子排布式:________。
(2)C2单质分子中,含有________个 键和________个
键和________个 键,元素B的气态氢化的空间构型为________。
键,元素B的气态氢化的空间构型为________。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示):________;
(4)D单质的熔点________A单质的熔点(填“高于”或“低于”),其原因是:________
________。
-
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
( 1)写出元素E基态原子的电子排布式:________,基态C原子的价电子轨道表示式是________。
(2)B单质分子中,含有________个 键和 个
键和 个 键。元素B的气态氢化的空间构型
键。元素B的气态氢化的空间构型
为 ________ ,其中B原子的杂化方式是 ________
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示):________;
(4)将B的氢化物的水溶液逐滴加入到CuSO4溶液中直到过量,观察到的现象是________,相关的离子方程式是________ 。
-
现有部分短周期主族元素的描述如下表:
| 元素编号 | 元 素 描 述 |
| W | 人体内含量最多的元素,且其单质是常见的助燃剂 |
| X | 第三周期中半径最小的元素 |
| Y | 原子核外最外层电子排布为nsnnpn |
| Z | 原子的最外层p亚层电子数等于次外层电子数 |
(1)元素W的原子的电子排布式:____________________
(2)元素X离子的电子式:________。
(3)元素Y的原子核外有________ 种电子云形状。
(4)元素Z的氢化物充分燃烧后,产生Z的氧化物与水的物质的量之比为2,
写出其中两种氢化物的名称、________,
(5)X、Z元素的最高价氧化物对应水化物的酸性强弱:________>________
(用化学式表示)。
-
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图______________。
(2)写出Y元素最高价氧化物分别与HCl、NaOH溶液反应的离子方程式____________________、______________________。
(3)写出Z的电子排布式_____、铬原子的简化的电子排布式______。
(4)元素T与氯元素相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___(填字母代号)。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号),理由是________________。
-
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
【答案】  Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO
Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO +2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
+2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
【解析】试题分析:T单质能与水剧烈反应,所得溶液呈弱酸性,所以T是F元素;X元素的L层p电子数比s电子数多2个,X元素是O元素;Y元素是第三周期元素的简单离子中半径最小,Y是Al元素;Z元素L层有三个未成对电子,Z是N元素;
解析:根据以上分析,(1)X为O元素,氧离子核外最外层达到8电子稳定结构,氧离子结构示意图 。
。
(2)Y元素最高价氧化物水化物Al(OH)3,为两性氢氧化物,与盐酸反应生成氯化铝和水,离子方程式为Al(OH)3+3H+===Al3++3H2O;与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-===AlO +2H2O;
+2H2O;
(3)Z是N元素,电子排布式是1s22s22p3; Y是Al元素,电子排布式是1s22s22p63s23p1。
(4)T是F元素,同主族元素从上到下,非金属性减弱,与氯元素相比,非金属性较强的是F;
A.气态氢化物的挥发性不能证明非金属性的强弱,故A错误;
B.单质分子中的键能,不能证明非金属性的强弱,故B错误;
C.非金属性越强,电负性越大,根据两元素的电负性可以判断非金属性,故C正确;
D.根据最高价含氧酸的酸性可以判断非金属性,故D错误;
E.键长越长,越不稳定,所以根据氢化物中X—H键的键长可以判断氢化物的稳定性,故E正确;
F.单质在自然界中的存在形式,不能判断非金属性,故F错误。
(5)Al为金属元素,具有金属性,其它三种元素为非金属元素,具有较强的非金属性。
点睛:元素非金属性强弱的判断方法:①越易与氢气化合,非金属性越强;②气态氢化物越稳定,非金属性越强;③单质的氧化性越强,非金属性越强;④最高价含氧酸的酸性越强,非金属性越强。
【题型】综合题
【结束】
21
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
-
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图____________。
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式______________
(3)写出Y的价电子排布式_________________________。
(4)元素T与氯元素相比,非金属性较强的是_______(用元素符号表示),下列表述中能用于证明这一事实的是_______(填字母代号)。
A.气态氢化物的挥发性 B.两元素的电负性
C.含氧酸的酸性 D.氢化物中X—H键的键长(X代表T和Cl两种元素)
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号)
-
现有部分短周期元素的性质或原子结构如下表:
| 元素 | 元素性质或原子的结构 |
| T | 2p轨道能级电子数比s能级电子数多1个 |
| X | L层p能级电子数比s能级电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有3个未成对电子 |
(1)写出元素X的离子结构示意图: .写出元素Z的简单气态氢化物的电子式: .
(2)写出元素Y的最高价氧化物对应的水化物与KOH反应的化学方程式: .
(3)T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是 (填元素符号,下同);元素T与氯化素相比,非金属性较强的是 ,下列表述中能证明这一事实的是 (填字母).
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出来
c.氯与T形成化合物中,氯元素呈正价.
-
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
(1)用化学用语回答下列问题:
①A元素在周期表中的位置________;
②B元素原子结构示意图________;
③C单质分子的电子式________;用电子式表示A和B元素组成的化合物的形成过程________;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素________.
(2)元素D与元素A相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是________(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下列过程转化为W(其他条件略去).
X Y
Y Z
Z W.
W.
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:________;生成该白色沉淀的化学方程式为________;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:________.
-
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 原子的电子排布图为 |
| B | 常温下单质为双原子分子,原子间形成三对共用电子对 |
| C | 原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D | 二价阳离子与C的阴离子具有相同的电子层结构 |
| E | 原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________;
(2)B的氢化物的分子空间构型是________,该氢化物的等电子体是________;
(3)E的价电子排布式是________,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为________;
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为________;
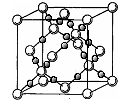
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构
的知识解释发光的原因:________。
-
(10分). 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T位于元素周期表的第______周期第_____族。写出T2-的原子结构示意图______________。
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________(填化学式)。
