-
室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
高三化学单选题困难题查看答案及解析
-
25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定25.00 mL0.1000 mol·L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是

A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O)= c(OH-)
B.点②所示溶液中:c(HC2O)+2c(C2O)= c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O)>c(H2C2O4)>c(C2O)
D.滴定过程中可能出现:c(Na+)>c(C2O)=c(HC2O)>c(H+)>c(OH-)
高三化学选择题困难题查看答案及解析
-
25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
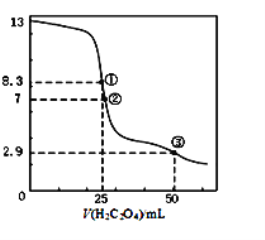
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
高三化学单选题中等难度题查看答案及解析
-
室温时,向20mL0.1000mol·L-1H2C2O4溶液中滴加0.1000mol·L-1NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示。下列有关叙述错误的是
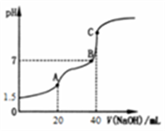
A. 忽略H2C2O4的第二步电离,由题给信息,可以计算出常温下H2C2O4的电离常数
B. A、B、C三点所对应的溶液中,水的电离程度最小的是A点
C. A、B、C三点所对应的溶液中,均有c(Na+)<c(OH-)+c(HC2O4-)+2c(C2O42-)
D. 在B点溶液中,生成的含钠化合物有两种,且n(HC2O4-)+n(C2O42-)=2.0×10-3mol
高三化学选择题困难题查看答案及解析
-
常温下,用0.1000mol·L-1的盐酸采用“双指示剂法"滴定25.00mL0.1000mol·L-1纯碱溶液,滴定曲线如图所示。下列说法正确的是( )
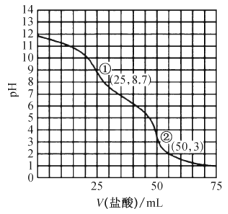
A.开始滴定到终点①过程应采用甲基橙作指示剂
B.由①到②的过程中会出现c(Na+)>2c(CO32-)+c (HCO3-)
C.滴定终点①处,水电离出的氢离子浓度约为10-8.7mol·L-1
D.滴定过程中含碳微粒的总浓度始终保持0.1000mol·L-1
高三化学单选题中等难度题查看答案及解析
-
室温下,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )
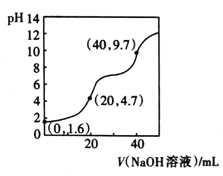
A.H3PO4的电离平衡常数Ka1约为10-2
B.当V(NaOH溶液)=40mL时,c(PO
)+c(OH-)=c(H+)+c(H2PO
)+2c(H3PO4)
C.当pH=7时,c(Na+)=c(H2PO
)+2c(HPO
)+3c(PO
)
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO
)>c(H3PO4)>c(HPO
)
高三化学单选题困难题查看答案及解析
-
室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是

A. 在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-)
B. 当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4)
C. 当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4)
D. 当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+)
高三化学多选题困难题查看答案及解析
-
25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol • L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )
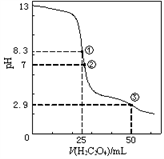
A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
高三化学选择题中等难度题查看答案及解析
-
用0.1000mol·L-1NaOH 标准溶液滴定未知浓度的盐酸溶液恰好滴定至终点,下列说法正确的是
A. 配制450mL0.1000mol·L-1的NaOH 溶液时,需用托盘天平称取NaOH 固体1.8 g
B. 滴定前准备工作中滴定管一般需要进行操作:查漏→洗涤→装液→调液面→记录
C. 若选用酚酞作指示剂,到达滴定终点时,锥形瓶内液体恰好褪色
D. 读取NaOH 溶液体积时,滴定前读数正确,滴定后俯视读数,则所测盐酸的浓度数值将偏低
高三化学单选题中等难度题查看答案及解析
-
25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定25.00 mL NaOH溶液所得滴定曲线如图。下列说法正确的是

A. 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4—)= c(OH—)
B. 点②所示溶液中:c(HC2O4—)+2c(C2O42—)=0.0500mol·L-1
C. 点③所示溶液中:c(Na+)>c(HC2O4—)> c(H2C2O4) > c(C2O42—)
D. 滴定过程中可能出现:c(Na+)>c(C2O42—)=c(HC2O4—)>c(H+)>c(OH—)
高三化学单选题困难题查看答案及解析