-
我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用__个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为__。
(2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是__(填元素符号),SO42-的空间构型为__,晶体中含有的化学键有__。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是__。
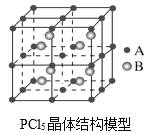
(3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为__,B为__。
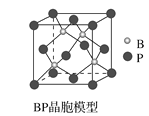
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为xcm,磷化硼的摩尔质量为bg·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式为__g·cm-3。
-
[化学-物质结构与性质]
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为______,请解释金属铜能导电的原因______.
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列______.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有______.
(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键,如NaCl;当小于1.7时,一般为共价键,如AlCl3.请写出铁元素和表中非金属元素形成的常见共价化合物:______.
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为______.
③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)______,其分子空间构型为______.
-
[化学―选修3:物质结构与性质]
研究物质的微观结构,有助于人们理解物质变化的本质。请根据已学习的物质结构知识,回答下列问题:
(l)基态Mn原子的价电子排布式为___,气态Mn2+再失去l个电子比Fe2+再失去1个电子更难,其原因是________。
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有_____。写出难溶物溶于氨水时的离子方程式__________。实验过程中加入C2H5OH 后可观察到析出深蓝色Cu(NH3)4SO4·5H2O晶体。实验中所加C2H5OH 的作用是______。
(3) HClO2、HClO3为氯元素的含氧酸,试推测ClO2-的空间结构:________;HClO3分子中,Cl原子的杂化方式为______;两种酸酸性较强的是_______.
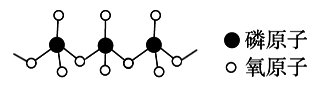
(4)多磷酸盐的酸根阴离子是由两个或两个以上磷氧四面体通过共用角顶氧原子而连接起来的,部分结构如图所示,多磷酸根离子的通式为______。(磷原子数目用n表示)
(5)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________。

已知金属Pt的密度为21.4 g/cm3,则Pt原子半径的计算式为______pm (只列式,不必计算结果,Pt的相对原子质量为M,阿伏加德罗常数为6.02×1023mol-1)。
-
【化学—选修3:物质结构和性质】(15分)
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是 ,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式 、 ,其中酸性较强的是 。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。
-
[选修3:物质结构与性质]
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有____________种;写出Cu+的核外电子排布式____________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有_________种,属于d区的元素有____________种。
(3)CaO晶胞如下图所示,CaO晶体中Ca2+的配位数为____________;
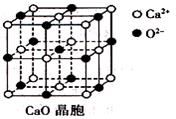
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子 ,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为___________,CNO-的中心原子的杂化方式为___________。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为_____________________。
-
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如所示,CaO晶体中Ca2+的配位数为________________________________ ;CaO的焰色反应为砖红色,许多金属或它们的化
合物都可以发生焰色反应,其原因是_______。
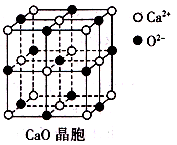
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是_______(填选项字母)。
A NaN3与KN3结构类似,前者晶格能较小
B晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C氮的第一电离能大于氧
D氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为______。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]X++ xR- Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
-
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第________周期第________族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH________(填“=”、“>”或“<”),理由是:(用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式。
-
卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区;氟原子的电子排布图为 溴原子的价电子排布式为 .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是
(3)已知高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A.CsICl2=CsCl+ICl B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为 型,中心氯原子的杂化轨道类型为 ,写出一个ClO2-的等电子体 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是 。

A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为 。
-
分卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的__________区;溴原子基态的价电子排布式为____________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是__________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__________(写出名称)。
| | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为____________,写出一个ClO2-的等电子体__________。
(5)下图为碘晶体晶胞结构。有关说法中正确的是_________。

碘晶体晶胞
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子交替形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(6)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

-
[化学-选修物质结构与性质]
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)RQ4Y分子的某中心原子采用的杂化轨道类型是______杂化.
(2)R、X、Y三种元素的第一电离能由小到大的顺序为______.
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与RY分子互为等电子体的分子和离子分别为______和______(填化学式).
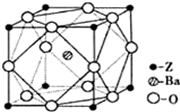
(4)Z元素位于周期表的______分区.Z原子基态时的外围电子排布式为______,Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为______.








 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6


