-
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) W (s) +3H2O (g) 请回答下列问题:
W (s) +3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为 。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)  W(s)+2H2O (g) ∆H=+66.0 kJ∙mol−1
W(s)+2H2O (g) ∆H=+66.0 kJ∙mol−1
WO2(g)+2H2(g)  W(s)+2H2O (g) ∆H=-137.9 kJ∙mol−1
W(s)+2H2O (g) ∆H=-137.9 kJ∙mol−1
则WO2(s)  WO2(g)的 ∆H= 。
WO2(g)的 ∆H= 。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) WI4(g)。下列说法正确的有 。
WI4(g)。下列说法正确的有 。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
-
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) W (s) +3H2O (g) 请回答下列问题:
W (s) +3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为 。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g) W(s)+2H2O (g) ∆H=+66.0 kJ∙mol−1
W(s)+2H2O (g) ∆H=+66.0 kJ∙mol−1
WO2(g)+2H2(g) W(s)+2H2O (g) ∆H=-137.9 kJ∙mol−1
W(s)+2H2O (g) ∆H=-137.9 kJ∙mol−1
则WO2(s) WO2(g)的 ∆H= 。
WO2(g)的 ∆H= 。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g)  WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
-
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2 (g)
 W (s)+3H2O (g)
W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为________.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应________(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为________.
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s)+2H2 (g)⇌W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2⇌W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2 (s)⇌WO2 (g) 的△H=________.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:
W(s)+2I2 (g)  WI4 (g).
WI4 (g).
下列说法正确的有________.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
-
(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为___________________________。
⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g) ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g) ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2(g)  W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1
则WO2 (s)  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)  WI4 (g)。下列说法正确的有________________。
WI4 (g)。下列说法正确的有________________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
 d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
-
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为____________ (填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)  WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
-
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s) + 3H2(g) W (s) + 3H2O (g),请回答下列问题:
W (s) + 3H2O (g),请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率______;该反应的平衡常数表达式K=_____。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为______(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2(g) WI4(g)。下列说法正确的有__________。
WI4(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
-
我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g) WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g) WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g) WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g) W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g) W(s)+3H2O(g) △H=_________, K=__________。
W(s)+3H2O(g) △H=_________, K=__________。
(3)T1℃时,将一定质量WO3和8.0g H2置于2 L密闭容器中,发生反应: WO3(s)+3H2(g) W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
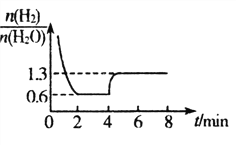
①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4 min时降低并维持温度为T2℃,则该反应的△H_______0,若在8 min时缩小容 器 容 积,则 _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
-
我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g) WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g) WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g) WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g) W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g) W(s)+3H2O(g) △H=_________, K=__________。
W(s)+3H2O(g) △H=_________, K=__________。
(3)T1℃时,将一定质量WO3和8.0g H2置于2 L密闭容器中,发生反应: WO3(s)+3H2(g) W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
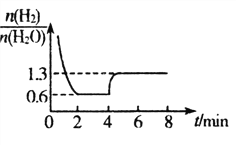
①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4 min时降低并维持温度为T2℃,则该反应的△H_______0,若在8 min时缩小容 器 容 积,则 _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
-
我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g) WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g) WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g) WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g) W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g) W(s)+3H2O(g) △H=_________, K=__________。
W(s)+3H2O(g) △H=_________, K=__________。
(3)T1℃时,将一定质量WO3和8.0g H2置于2 L密闭容器中,发生反应: WO3(s)+3H2(g) W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4 min时降低并维持温度为T2℃,则该反应的△H_______0,若在8 min时缩小容 器 容 积,则 _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
-
金属铬在工业上有广泛用途,主要用于不锈钢及高温合金的生产。铬铵矾(NH4Cr(SO4)2·12H2O)法是一种以碳素铬铁(主要是由Cr、Fe、 C形成的合金)为主要原料生产金属铬,并能获得副产物铁铵矾【(NH4Cr(SO4)2·12H2O)】的方法。有关流程如下:
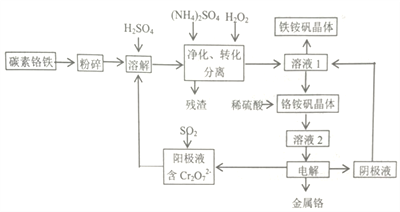
己知部分阳离子以氢氧化物开始沉淀和完全沉淀的pH如下表(金属离子浓度为0.01mol/L):
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
| 开始沉淀的pH | 7.6 | 2.7 | 4.9 |
| 完全沉淀的pH | 9.6 | 3.7 | 6.8 |
(1)溶解碳素铬铁前需将其粉碎,其目的是____________
(2)净化和转化阶段:所得残渣的主要成分是___________,转化时需要添加定量的H2O2,其目的是__________。由溶液1获得铁铵矾晶体的操作方法为______,过滤、洗涤、干燥。
(3)将铬铵矾晶体溶于稀硫酸,而不是直接溶于水的主要原因是_________________。
(4)阳极液通入SO2的离子反应方程式______________。
(5)工业废水中含有一定量的Cr3+,也含有一定量的Mg2+、Ca2+,而除去“钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp (CaF2) =1.05×10-10,当加入过量NaF使两种沉淀共存时,溶液中c(Mg2+)/c(Ca2+)=__________。
(6)某课外活动小组将铬铵矾(NH4CrSO4)·12H2O) 经过一系列操作获得了 Cr2(CO3)3粗品。该小组利用EDTA (乙二胺四乙酸二钠,阴离子简写为H2Y2-)测定粗品中Cr2(CO3)3的质量分数,准确称取2.00g粗品试样,溶于5.0mL稀盐酸中,依次加入5.0mL NH3·NH4Cl缓冲溶液、0.10g紫脲酸铵混合指示剂,用0.100mol/LEDTA标准溶液滴定至呈稳定颜色,平均消耗标准溶液5.00mL已知: Cr3++H2Y2-=CrY+2H+。
①滴定操作中,如果滴定前装有EDIA标准溶液的满定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_____(填“偏大”、 “偏小”或“不变”)。
②粗品中Cr2(CO3)3的质量分数w[Cr2(CO3)3]=____。
W (s) + 3H2O (g),请回答下列问题:
WI4(g)。下列说法正确的有__________。



