-
25℃时,用0.1mol·L-1的KOH溶液滴定10mL0.1mol·L-1的H2C2O4溶液,所得滴定曲线如图所示。忽略混合时溶液体积的变化,下列有关各点溶液中粒子浓度关系正确的是

A.a点溶液中:c(H+)=0.1mol·L-1+c(OH-)-c(H2C2O4)+c(C2O42-)
B.b点溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.c点溶液中:c(K+)<c(C2O42-)-c(H2C2O4)+0.1mol·L-1
D.d点溶液中:c(OH-)-c(H+)=c(H2C2O4)+c(HC2O4-)
-
常温下,用0.05mol•L﹣1 KOH溶液滴定 10.00mL0.05mol•L﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
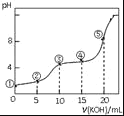
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 mol•L﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
-
常温下,用0.05mol•L﹣1 KOH溶液滴定 10.00mL0.05mol•L﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
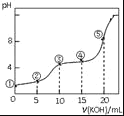
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 mol•L﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
-
常温下,用0.05mol•L﹣1 KOH溶液滴定 10.00mL0.05mol•L﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法正确的是( )

A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+2c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 mol•L﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是( )
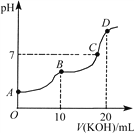
A. KHC2O4溶液呈弱碱性
B. B点时:c(K+)>c(HC2O4-)> c(C2O42-)>c(H+)>c(OH-)
C. C点时:c(K+)>c(HC2O4-)+c(C2O42-)+c(H2C2O4)
D. D点时:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1 mol·L-1
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是( )
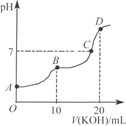
A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是

A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<
c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+ c(HC2O4-)+ c(H2C2O4)= c(OH-)
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
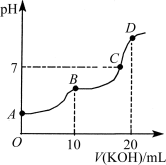
A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)> c(C2O42-)>c(H+)>c(OH-)
C.C点时:c(K+)>c(HC2O4-)+c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
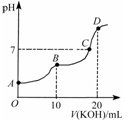
A.KHC2O4溶液呈弱碱性
B.B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
-
用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是( )
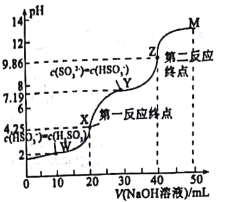
A.Ka2(H2SO3)的数量级为10-8
B.向X点加入少量澄清石灰水溶液, 的值增大
的值增大
C.若将n(NaHSO3)与n(Na2SO3)=1:1混合,对应的点应在Y、Z之间
D.图中溶液中水的电离程度:W<X<Y<Z







