-
研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g) △H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
| 化学键 | C—H | H—H | C=O | 
|
| 键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
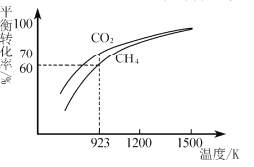
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
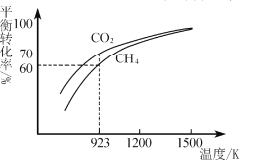
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
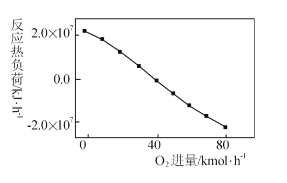
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
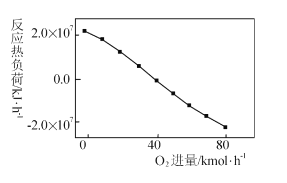
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
-
研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g) △H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
| 化学键 | C—H | H—H | C=O | 
|
| 键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
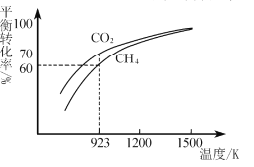
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
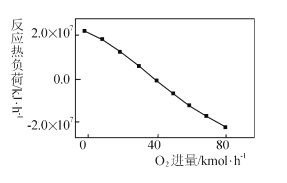
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
-
研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g) △H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
| 化学键 | C—H | H—H | C=O | 
|
| 键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
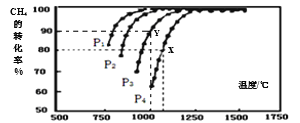
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________。
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
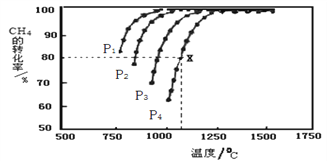
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因_________________________。
②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_____________________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是____________________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向___________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为_____________________。
-
研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
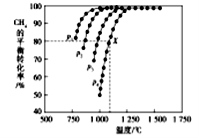
①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
-
(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
则CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
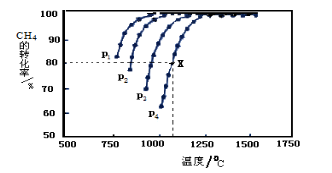
据图可知,P1 、P2、 P3 、P4 由大到小的顺序 。
在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
A.体系压强不再变化 B.H2与CO的物质的量之比为1 :1
C.混合气体的密度保持不变 D. 气体平均相对分子质量为15,且保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、
2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH= kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2在一定条件下发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图
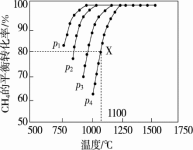
据图可知,p1、p2、p3、p4由大到小的顺序是 。在压强为p4、1100 ℃的条件下,该反应在5 min时达到平衡点X,该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2(g)来制取。
CO(g)+H2(g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定反应已达到平衡的是__________。
A.体系压强不再变化 B.H2与CO的物质的量之比为1∶1
C.混合气体的密度保持不变 D.气体平均相对分子质量为15,且保持不变
②在某密闭容器中同时投入四种物质,2 min时达到平衡,测得容器中有1 mol H2O(g)、1 mol CO(g)、2.2 molH2(g)和一定量的C(s),若此时对体系加压,则平衡向 (填“正”或“逆”)反应方向移动,第5 min时达到新的平衡,请在右图中 画出2~5 min容器中气体平均相对分子质量的变化曲线。
画出2~5 min容器中气体平均相对分子质量的变化曲线。
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH= kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2在一定条件下发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图
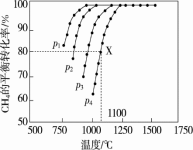
据图可知,p1、p2、p3、p4由大到小的顺序是 。在压强为p4、1100 ℃的条件下,该反应在5 min时达到平衡点X,该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2(g)来制取。
CO(g)+H2(g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定反应已达到平衡的是__________。
A.体系压强不再变化 B.H2与CO的物质的量之比为1∶1
C.混合气体的密度保持不变 D.气体平均相对分子质量为15,且保持不变
②在某密闭容器中同时投入四种物质,2 min时达到平衡,测得容器中有1 mol H2O(g)、1 mol CO(g)、2.2 molH2(g)和一定量的C(s),若此时对体系加压,则平衡向 (填“正”或“逆”)反应方向移动,第5 min时达到新的平衡,请在右图中 画出2~5 min容器中气体平均相对分子质量的变化曲线。
画出2~5 min容器中气体平均相对分子质量的变化曲线。
-
探索CO2与CH4的反应使其转化为CO和H2,对减缓燃料危机,减少温室效应具有重要意义。回答下列问题
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) CH3OH(1) △H2=-128.3kJ·mol-1
CH3OH(1) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为______________________。
(2)向某密闭恒容容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
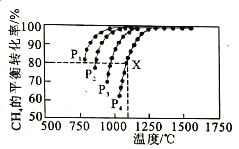
①工业生产时一般会选择在P4和1250℃条件下进行反应,请解释其原因______________________。
②在压强为P4、1100℃的条件下,该反应在5min时达到平衡点X,则0-5min内,用CO表示该反应平均速率为___________;该温度下,反应的平衡常数为___________(保留3位有效数字)。
(3)工业上用CO和H2制取甲醇反应方程式为2H2(g)+CO(g) CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
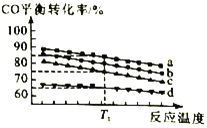
①曲线b对应的投料比是___________
②当反应在曲线a、b、c对应的投料比下达到相同的平衡转化率时,对应的反应温度和投料比的关系是___________。
③投料比为10︰17反应温度为T1时,平衡混合气体中CO的物质的量分数为___________。
















