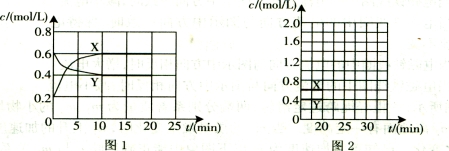-
将一定量的NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,各物质的浓度随时间的变化如图1所示,请回答下列问题:
(1)图1中,曲线_______(填“X”或“Y”)表示NO2浓度随时间的变化情况,前10min内v(NO2)=_______mol/(L· min);
(2)下列选项中不能说明该反应已达到平衡状态的是____(填选项字母)
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为______________________,该反应的平衡常数K=_____________;
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1______w2(填“>”“=”或“<”)
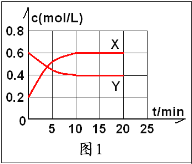
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)________________
-
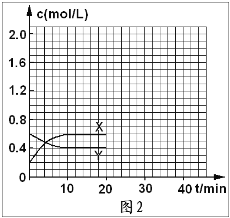
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为 ;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
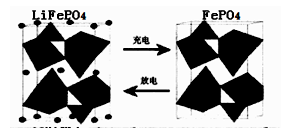
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
-
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
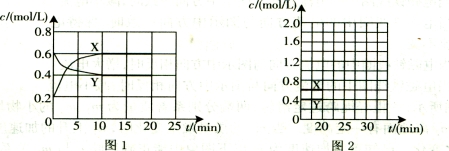
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)=0.9 mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
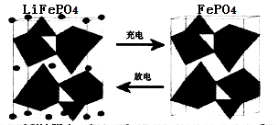
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
-
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
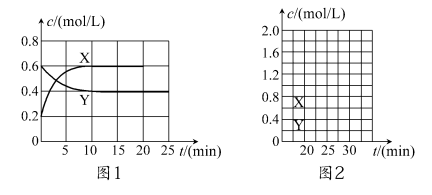
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而变化
(3)反应进行到10 min时,共吸收热量22.76 kJ,则该反应的热化学方程式为_________________________________;该反应的平衡常数K=________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
-
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
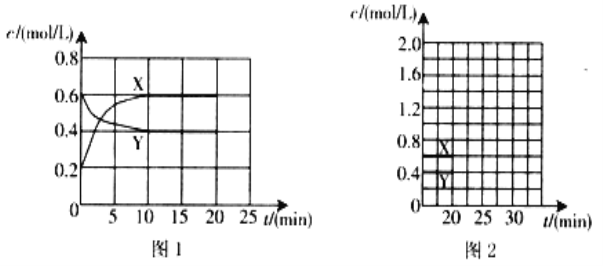
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是____________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为_________________;
(3)计算该反应的平衡常数K=___________________________________________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1_______w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)________。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
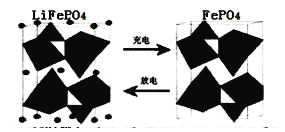
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_______________极(填“正”或“负”),该电极反应式为_______________________________________。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
-
已知NO2与N2O4 可相互转化: 2NO2( g) N2O4(g) △H=−24.2 kJ• mol−1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是
N2O4(g) △H=−24.2 kJ• mol−1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是
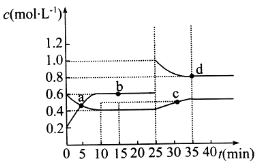
A.前10 min内,用v(NO2)表示的反应速率为0. 02 mol•L−1•min−1
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.b、d两点中v(正)与v(逆)均相等
D.25 min时,正反应速率增大
-
已知NO2与N2O4相互转化:2NO2(g) N2O4(g);△H=-24.2kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如右图。下列推理分析合理的是( )
N2O4(g);△H=-24.2kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如右图。下列推理分析合理的是( )
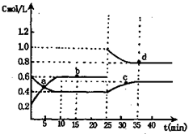
A.a,b,c,d四点中c正与v逆均相等
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.前10min内,用v(NO2)表示的该反应速率为0.02mol/L·min
D.25min时,导致平衡移动的原因是升温
-
已知NO2与N2O4相互转化:2NO2(g) N2O4(g);△H=-24.4kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如下图。下列推理分析合理的是( )
N2O4(g);△H=-24.4kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如下图。下列推理分析合理的是( )
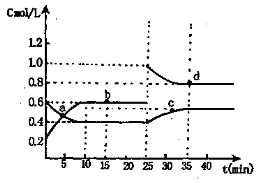
A.前10min内,用v(NO2)表示的该反应速率为0.02mol/(L·min)
B.反应进行到10min时,体系吸收的热量为9.76kJ
C.a,b,c,d四点中v正与v逆均相等
D.25min时,导致平衡移动的原因是升温
-
已知NO2和N2O4可以相互转化:2NO2(g)
 N2O4(g);Q>0现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
N2O4(g);Q>0现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
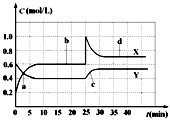
A.图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和c
C.反应进行至25min时,曲线发生变化的原因是加入0.4molN2O4
D.若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积
-
NO2和N2O4可相互转化:2NO2(g) N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是( )
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是( )
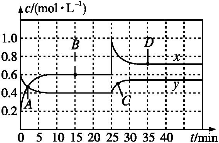
A.图中共有两条曲线x和y,其中曲线y表示NO2浓度随时间的变化
B.A、B、C、D四个点中,表示化学反应处于平衡状态的点是B和C
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与D相同的状态,在25 min时还可采取的措施是适当缩小容器体积