-
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和______________。(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是__________;不宜用盐酸的原因是____________。反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤。该步骤能够得到高锰酸钾的原理是____________。
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知涉及到的反应:
Na2C2O4+H2SO4=H2C2O4(草酸)+Na2SO4 ,
5H2C2O4+ 2MnO4—+6H+=2Mn2++10CO2↑+ 8H2O
Na2C2O4的式量:134 KMnO4的式量:158)
Ⅰ.称取0.80 g 的高锰酸钾产品,配成50mL溶液。
Ⅱ.称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL。
a.判断达到滴定终点的标志是____________________________。
b.样品中高锰酸钾的质量分数为______________(保留3位小数)。
c.加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度__________。(填“偏高”、“偏低”或“无影响”)
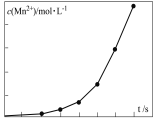
d.将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为_______________。
-
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。

-
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3 。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④钨坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
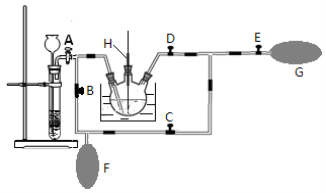
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②通入CO2后,用玻璃棒蘸取溶液点在滤纸上,观察到 证明歧化反应已发生。
(3)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,蒸发浓缩,自然冷却结晶,过滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是___________。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用滴定管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留3位有效数字,已知M(KMnO4)=158g·mol-1)。若量取待测液的滴定管用蒸馏水洗净后没有用待测液润洗或烘干,则最终测定结果将 。(填“偏大”、“偏小”、“不变”)
-
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3 。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在_______________中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
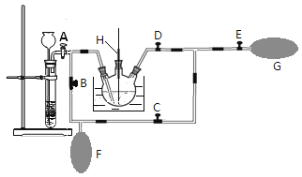
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞__________,打开旋塞____________,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是_______________________________________。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至____________,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是________________。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:2MnO4-+5C2O42+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为_________(保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将_________。(填“偏大”、“偏小”、“不变”)
-
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3 。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
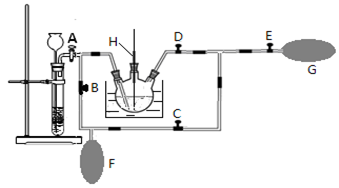
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是 。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至 ,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是 。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将 。(填“偏大”、“偏小”、“不变”)
-
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O;
3K2MnO4+ KCl+3H2O;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是 。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至 ,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是____________。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将 。(填“偏大”、“偏小”、“不变”)
-
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O;
3K2MnO4+ KCl+3H2O;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是 。
(3)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将 。(填“偏大”、“偏小”、“不变”)
-
(14分)高锰酸钾广泛用作氧化剂、防腐剂、消毒剂、除臭剂及解毒剂。常见的制备流程如下:

已知:a.3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O B.3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
请回答下列问题:
(1)步骤①中反应所选用的坩埚不能用 。
A.石英坩埚 B.铁坩埚 C.瓷坩埚 D.石墨坩埚
(2)步骤③通CO2的目的是为了调节溶液的pH,能否改用氯化氢 (填“能”或“否”),原因是 。
(3)步骤④中抽滤得到的固体是 。
(4)抽滤装置主要由 、安全瓶、抽气泵和布氏漏斗四部分组成,该实验中抽滤时能否用滤纸?______(填“能”或“不能”), 理由是_____。
(5)从滤液⑤得到高锰酸钾的后续操作步骤是____。
-
KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:
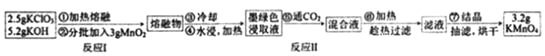
反应原理:
反应I:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
| K2CO3 | KHCO3 | KMnO4 |
| 111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 2.65 | 22.67 |
| 2 | 2.60 | 23.00 |
| 3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。
-
锰酸钾可用于油脂、纤维、皮革的漂白等,其可由KOH、KClO3和MnO2经共熔制备,反应原理为6KOH+KClO3+3MnO2 KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
A.KOH和KCl中均含有共价键
B.MnO2在反应中被还原
C.K2MnO4的氧化性大于KClO3
D.该反应中,每生成3 mol K2MnO4转移的电子数为6×6.02×1023
3K2MnO4+KCl+3H2O
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。







