-
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| ① | H2(g)+ O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; |
| ② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; |
| ③ | C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; |
| ④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; |
| ⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H = + 802kJ/moL |
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | |
| | | | | | | | | | |
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g) H2(g)+ CO(g)△H = ___________ kJ/moL;
H2(g)+ CO(g)△H = ___________ kJ/moL;
(3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2 J/(g·℃) ]。
-
在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)人类利用能源分为三个阶段,即________、________、________。
(2)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是________。(填序号,下同)
A.石油 B.煤 C.天然气 D.生物质能
(3)下列对能源的看法合理的是 ( )。
A.化石能源属于不可再生能源,只会越用越少
B.生物能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会
-
能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式:
①H2(g)+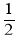 O2(g)= H2O( g) ΔH = - 242kJ/mol;
O2(g)= H2O( g) ΔH = - 242kJ/mol;
②2H2(g)+ O2(g)= 2H2O( l) ΔH= - 572kJ/mol;
③C(s)+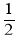 O2(g)=CO (g) ΔH =-110.5 kJ/mol;
O2(g)=CO (g) ΔH =-110.5 kJ/mol;
④C(s)+O2(g)= CO2(g) ΔH=- 393.5 kJ/mol;
⑤CO2(g)+2H2O(g)= CH4(g)+ 2O2( g) ΔH = + 802kJ/mol:
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能 kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式 ___________;
(2)已知C(s)+ H2O(g) H2(g)+ CO(g) ΔH =_______kJ/mol;
H2(g)+ CO(g) ΔH =_______kJ/mol;
(3)估算出C=O键能为____kJ/mol:
(4)CH4的燃烧热ΔH = _______kJ/mol:
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开 1L 水所需要的CH4的物质的量为_____mol[保留到小数点后2位:已知:c(H2O)=4.2J/(g•℃)]。
-
在人类生产、生活所需能量日益增多的今天,研究化学反应及其能量变化对合理利用常规能源和开发新能源具有十分重要的意义。下列说法中不正确的是 ( )
A.任何化学反应都伴随着能量的变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量,反应释放能量
D.若化学键形成时释放的能量小于旧化学键被破坏时需要吸收的能量,反应吸收能量
-
在人类生产、生活所需能量日益增多的今天,研究化学反应及其能量变化对合理利用常规能源和开发新能源具有十分重要的意义。下列说法中不正确的是
A.任何化学反应都伴随着能量的变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量,反应释放能量
D.若化学键形成时释放的能量小于旧化学键被破坏时需要吸收的能量,反应吸收能量
-
在人类生产、生活所需能量日益增多的今天,研究化学反应及其能量变化对合理利用常规能源和开发新能源具有十分重要的意义。下列说法中不正确的是
A. 任何化学反应都伴随着能量的变化
B. 因地制宜开发利用风能、水能、地热能、潮汐能
C. 若化学键形成时释放的能量小于旧化学键被破坏时需要吸收的能量,反应吸收能量
D. 煤、石油天然气均为化石能源,是可再生能源
-
在人类生产、生活所需能量日益增多的今天,研究化学反应及其能量变化对合理利用常规能源和开发新能源具有十分重要的意义。下列说法中不正确的是
A.任何化学反应都伴随着能量的变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量,反应释放能量
D.若化学键形成时释放的能量小于旧化学键被破坏时需要吸收的能量,反应吸收能量
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
-
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)CH4既是一种重要的能源,也是一种重要的化工原料。已知 8.0 g CH4完全燃烧生成液态水放出445.15 kJ热量,则其热化学方程式为_____。
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____左右。
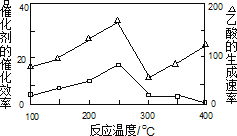
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_____。
③CH4 还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为 N2和O2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为_____。
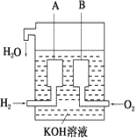
(3)美国阿波罗宇宙飞船上使用了一种新型电池装置,其构造如下图所示,A、B两个电极均由多孔的炭块组成。该电池的负极反应式为:_____。
若该电池工作时增加了1 mol H2O,电路中转移电子的物质的量为_________。
-
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:

(1)从能量的角度看,旧键断裂,新键形成必然有能量变化.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成2mol HI需要_______(填“放出”或“吸收”)_______kJ的热量.
(2)在生产和生活中经常遇到化学能与电能的相互转化.
在如图甲、乙两装置中,甲中负极电极反应式为__________________,溶液中的阴离子向
______极移动(填“Zn”或“Pt”);乙中铜电极作_______极,发生_______反应(填“氧化”或“还原”).
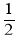 O2(g)= H2O( g) ΔH = - 242kJ/mol;
O2(g)= H2O( g) ΔH = - 242kJ/mol;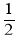 O2(g)=CO (g) ΔH =-110.5 kJ/mol;
O2(g)=CO (g) ΔH =-110.5 kJ/mol;  H2(g)+ CO(g) ΔH =_______kJ/mol;
H2(g)+ CO(g) ΔH =_______kJ/mol;


