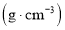-
乙酸乙酯是一种重要的化工原料,广泛用于药物染料、香料等工业。查阅资料得到下列数据:
| 物质 | 沸点/℃ | 密度/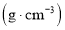 | 相对分子质量 | 水溶性 |
| 乙醇 | 78.0 | 0.8 | 46 | 互溶 |
| 乙酸 | 118.0 | 1.1 | 60 | 可溶 |
| 乙酸乙酯 | 77.5 | 0.9 | 88 | 微溶 |
| 乙醚 | 34.6℃ | 0.7 | 74 | 微溶 |
| 浓硫酸(98%) | 338.0 | 1.8 | 98 | 易溶 |
| 无水氯化钙 | 可与乙醇形成难溶于水的CaCl2·6C2H5OH |
请回答以下问题:
(1)实验室常用下图装置来制备乙酸乙酯。
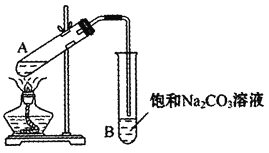
①配制反应混合液时,乙醇、冰醋酸和浓硫酸的混合顺序是________;浓硫酸对反应有催化作用,但加入的浓硫酸不能太多也不能太少,原因是________。
②防止加热时液体暴沸,需要在试管加入碎瓷片,如果加热一段时间后发现忘记了加碎瓷片,应该采取的正确操作是________。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③实验中饱和碳酸钠溶液的作用是________。
(2)产品纯化。分液法从试管B中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入无水氯化钙,除去________(填名称);然后再加入无水硫酸钠除去水,最后进行________(填操作名称),得到较纯净的乙酸乙酯。
(3)该实验中用30 g乙酸与46 g乙醇反应,如果实际得到的乙酸乙酯的质量是30.8 g,则该实验中乙酸乙酯的产率是________。(产率指的是某种生成物的实际产量与理论产量的比值)
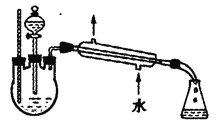
(4)另一化学小组设计下图所示的装置制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)。此装置和上图装置相比的优点是________(写出一条即可)。
-
乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是
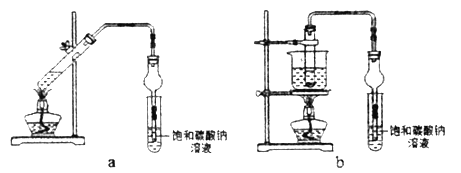
A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
-
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备.
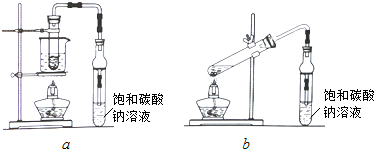
完成下列填空:
(1)用a装置进行实验时,烧杯中的液体是用___________(选填“沸点较高的油”、“水”);装置a, b中均使用了防倒吸装置,产生倒吸的主要原因是___________。加入数滴浓硫酸既能起催化作用,但实际用量多于此量,原因是___________;浓硫酸用量又不能过多,原因是___________。
(2)反应结束后,将试管中收集到的产品倒入分液漏斗中,___________、___________,然后分液。
(3)若用b装置制备乙酸乙酯,其缺点有___________、___________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是___________,分离乙酸乙酯与该杂质的方法是___________。其中饱和食盐水洗涤的主要作用是___________,饱和氯化钙溶液洗涤是为除去___________杂质。
-
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
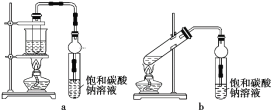
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;
(2)饱和Na2CO3溶液的作用是________、_______、________。
(3)写出反应原理:________。
(4)若用b装置制备乙酸乙酯,其缺点有_______、________。由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是_______,分离乙酸乙酯与该杂质的方法是______。
-
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验可用a装置来制备。完成下列填空:
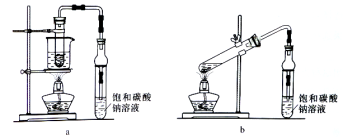
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
-
苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸(C6H5COOH)和甲醇为原料制备苯甲酸甲酯。有关数据如下:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g/cm3) | 水溶性 |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。
回答下列问题:
(1)该反应的化学方程式为__________,该反应的原子利用率是_______。
己知:原子利用率=(预期产物的总质量/全部反应物的总质量)×100%
(2)实验中,应选择(如下图)_____(填序号)作为冷凝回流装置,该仪器的名称为______。
(3)使用过量甲醇的原因是__________。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。
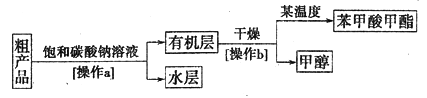
(4)饱和碳酸钠溶液的作用是________,操作a的名称为________。
(5)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论__________。
(6)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为________。
-
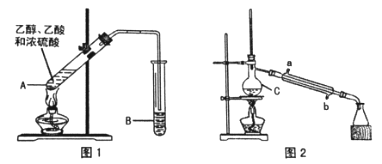
乙酸乙酯广泛用于药物、燃料、香料等工业,在中学化学实验室里常用下图装置来制备乙酸乙酯。(部分夹持仪器已略去)
已知:
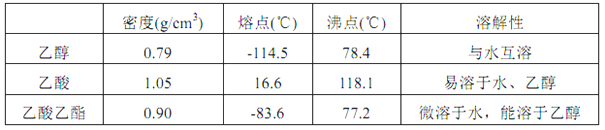
(1)制备粗品(图1)
在A 中加入少量碎瓷片,将三种原料依次加入A 中,用酒精灯缓慢加热,一段时间后在B 中得到乙酸乙酯粗品。
①浓硫酸、乙醇、乙酸的加入顺序是_______________________,A 中发生反应的化学方程式是______________________________。
②A 中碎瓷片的作用是_____________________________________,长导管除了导气外,还具有的作用是_____________________________。
③B 中盛装的液体是_____________________,收集到的乙酸乙酯在 ___________层(填“上”或“下”)。
(2)制备精品(图2)
将B 中的液体分液,对乙酸乙酯粗品进行一系列除杂操作后转移到C 中,利用图2 装置进一步操作即得到乙酸乙酯精品。
①C 的名称是___________________。
②实验过程中,冷却水从_________口进入(填字母);收集产品时,控制的温度应在________℃左右。
-
乙酸乙酯广泛存在于药物、染料、香料等工业,中学化学实验常用装置来制备:
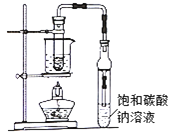
完成下列填空:
(1)写出实验室制备乙酸乙酯的化学方程式:_______通常加入过量乙醇,原因是_______
(2)饱和碳酸钠溶液的作用是①__________②__________
(3)若用装置制备乙酸乙酯,其缺点有_________、_________。边反应边通过分液漏斗边滴加乙酸,边加热蒸出乙酸乙酯。这样操作可以提高酯的产率。其原因是______
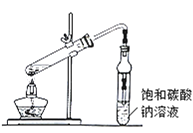
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物。下列框图是分离操作步骤流程图:
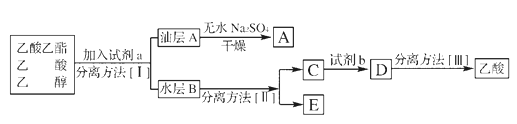
分离方法II是____________试剂b是____________。
-
乙酸乙酯广泛用于药物、染料、香料等工业, 某学习小组设计甲、乙两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯。下列说法不正确的是

A.浓硫酸能加快酯化反应速率
B.装置乙中的球形干燥管能防止倒吸
C.振荡a、b 两试管发现油状液体层变薄 ,主要是乙酸乙酯溶于Na2CO3溶液所致
D.可用分液的方法分离出乙酸乙酯
-
【化学——选修2:化学与技术】
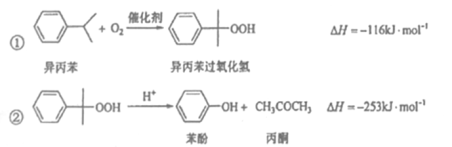
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. NaOH b. CaCO3 c. NaHCO3 d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。