-
焦亚硫酸钠(Na2S2O5)是生产、生活中重要的物质,受热易分解,实验室制备Na2S2O5的实验流程如下:
H2SO4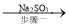 SO2
SO2 Na2S2O5溶液
Na2S2O5溶液 Na2S2O5晶体
Na2S2O5晶体 Na2S2O5
Na2S2O5
(1)步骤一中一般用70%的H2SO4,H2SO4浓度过小或过大均不利于SO2的逸出,原因是_______。
(2)步骤二的实验装置如图:

①三颈烧瓶中发生反应的化学方程式为_________。
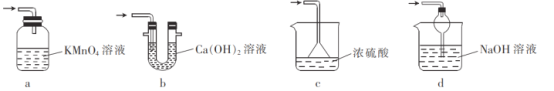
②处理尾气,选用的最合理的装置(夹持装置已略去)为_______(填标号)。
(3)“操作1”包括的操作有低温蒸发、结晶、____、洗涤。洗涤时先用饱和SO2水溶液,再用无水乙醇,用饱和SO2水溶液、无水乙醇洗涤产品的共同优点是____,用无水乙醇洗涤的另外一个优点是_____。
(4)“步骤四”脱水需在N2的气氛中低温烘干,原因是______。
(5)用酸性KMnO4溶液______(填“能”或“不能”)鉴别出产品Na2S2O5中含有Na2SO4。
(6)产品纯度检验:取1.0 g Na2S2O5产品溶于水配成100 mL溶液,取上述配好的溶液25.00 mL,用0.1 mol·L-1的碘标准液滴定至终点,消耗24.00 mL碘标准液,该样品中Na2S2O5的纯度为_____。(其他杂质不参与反应)
-
工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5).其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3 ⇌Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为:_____________________________________________________ .
(2)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:__________________________.
(3)反应I时应先通的气体为______,副产品X的化学式是______.
(4)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为______.检验产品中含有碳酸钠杂质所需试剂是______(填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸.
-
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2 Na2S2O5。
Na2S2O5。
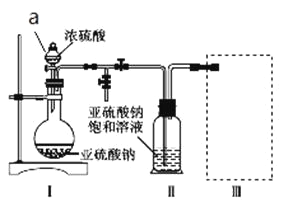
(1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。
(2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。
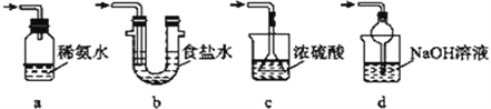
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。
-
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2 Na2S2O5。
Na2S2O5。
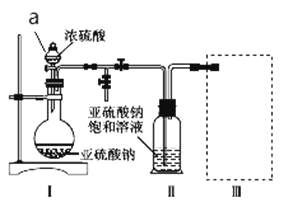
(1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。
(2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。
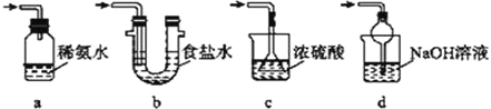
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。
-
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
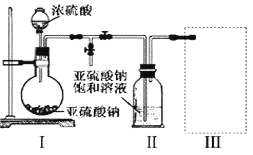
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3+ SO2= Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为_____________________________。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______________。
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填序号)。
(2)(查阅资料)Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是_______________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
-
胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
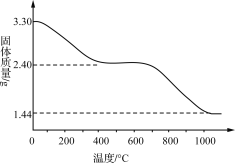
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
-
硫的化合物种类较多,用途广泛。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。

(1)写出装置甲中发生反应的化学方程式__________________。
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:_________________________。
方法2:_________________________。
方法3:_________________________。
(3)装置乙的作用是________________。
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式_____________。
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。
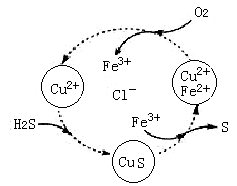
(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为 _____________。
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是___________________。
(3)写出图中各步转化的化学方程式:____________________。
-
铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
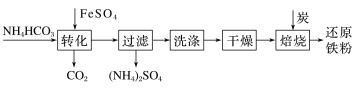
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3溶液在如下装置模拟上述流程中的“转化”环节。
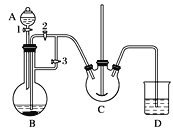
(1)装置A的仪器名称是________,装置B中盛放的药品是________。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是____________________。FeSO4溶液要现用现配制的原因是_____________________。
(3)干燥过程的主要目的是脱去产物FeCO3中的游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为_________________________________________,取干燥后的FeCO3样品24.98 g,与炭混合后焙烧,最终得到还原铁粉12.32 g,计算样品中FeCO3的质量分数________%(计算结果取整数)。

(4)高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________
(5)25 ℃时,Ksp[Fe(OH)3]=4.0×10-38 ,此温度下,若实验室中配制2.5mol/L 100mL硫酸铁溶液,为使配制过程中不出现浑浊,则至少需要加入10mol/L的硫酸______mL(忽略加入硫酸的体积)。
-
硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
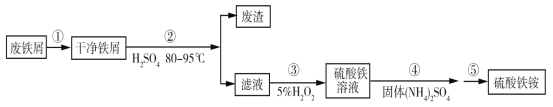
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
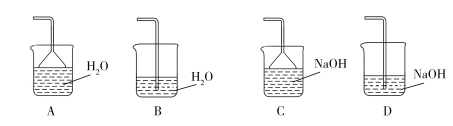
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
-
硫酸铁铵(NH4Fe(SO4)2·xH2O)是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:
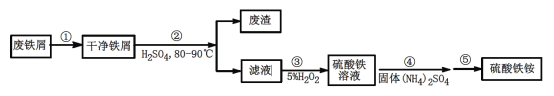
(1)步骤②需要加热的目的是_______________
(2)步骤②温度保持80-95℃,采用的合适加热方式是_____________________
(3)步骤③加入5%H2O2的目的是将Fe2+全部氧化为Fe3+,不引入杂质,请写出反应的离子方程式__________________________
 SO2
SO2 Na2S2O5溶液
Na2S2O5溶液 Na2S2O5晶体
Na2S2O5晶体 Na2S2O5
Na2S2O5



















