-
向1.00L浓度均为0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl气体调节溶液pH(忽略溶液体积变化)。其中比H2SO3、HSO3-、SO32-平衡时的分布系数(各含硫物种的浓度与含硫物种总浓度的比)随HCl气体体积(标况下)的变化关系如图所示(忽略SO2气体的逸出);已知Ka1代表H2SO3在该实验条件下的一级电离常数。下列说法正确的是
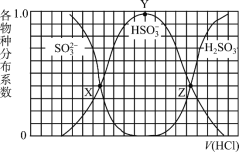
A.Z点处的pH=-lgKa1(H2SO3)
B.从X点到Y点发生的主要反应为SO32- +H2O⇌HSO3- +OH-
C.当V(HCl)≥672mL时,c(HSO3-) = c(SO32-)=0mol/L
D.若将HCl改为NO2,Y点对应位置不变
-
在25℃时,将1.0Lc mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
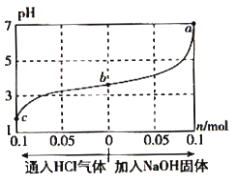
A.水的电离程度:a>b>c
B.b点对应的混合溶液中:c(Na+)<c(CH3COO-)
C.c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为
-
在25℃时,将1.0Lc mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
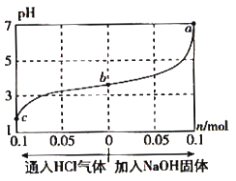
A.水的电离程度:a>b>c
B.b点对应的混合溶液中:c(Na+)<c(CH3COO-)
C.c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
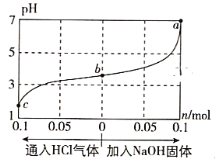
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
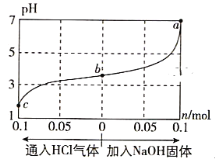
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
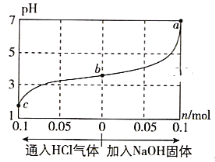
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
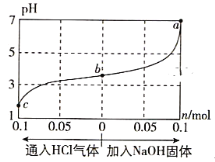
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
-
常温下,将1.0L X mol/L CH3COOH溶液与0.1mol NaOH固体混合充分反应,再向该混合溶液中通人HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列说法正确的是
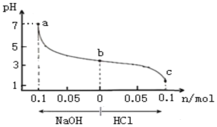
A.X<0.1
B.b→a过程中,水的电离程度逐渐增大
C.Ka (CH3COOH) =10-8/(X-0.1)
D.b→c过程中,c(CH3COOH)/c(CH3COO) 逐渐变小
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
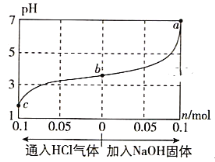
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
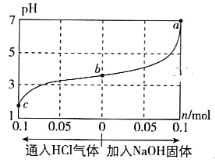
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数









