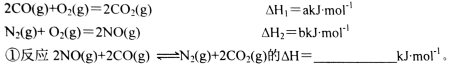-
选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=a kJ∙mol-1
②2NO(g)+2CO(g) ⇋ N2(g)+ 2CO2(g) ∆H2=b kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=____________kJ∙mol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 ____________。
②在该温度下反应的平衡常数K=________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
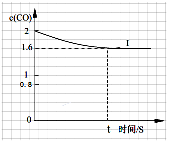
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。______________
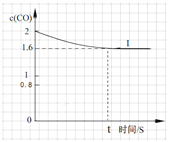
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
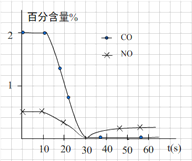
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是__________________。
-
(16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=a kJ∙mol-1
②2NO(g)+2CO(g) ⇋ N2(g)+ 2CO2(g) ∆H2=b kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H= kJ∙mol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K= 。
③关于上述反应,下列叙述不正确的是 (填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
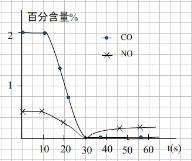
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是 。
-
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol·L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
经分析,得出结论不正确的是
A.2~3 s间的平均反应速率v(NO)=9×10-5 mol/(L·s)
B.催化转化器对废气的转化速率在夏季时比冬季时高
C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a J
D.该温度下,此反应的平衡常数K=5000
-
(18分)(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知:
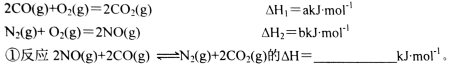
②可以利用反应: (n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2____________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式________________________________________
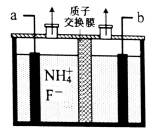
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于_______法。
-
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
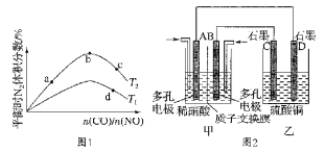
①b点时,平衡体系中C、N原子个数之比接近___;
②a、b、c三点CO的转化率从大到小的顺序为___;a、c、d三点的平衡常数从大到小的顺序为___。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____(填化学式);A电极的电极反应式为____;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___(填“酸性”“碱性”或“中性”)。
-
化学与生活、能源、环境等密切相关。下列描述错误的是( )
A. 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
B. “雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C. 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染
D. 氮化硅陶瓷是一种新型无机非金属材料
-
化学与生活、能源、环境等密切相关。下列描述错误的是( )
A.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
B.“雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是单质硅
D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
-
化学与生活、能源、环境等密切相关。下列描述错误的是( )
A.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
B.“雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C.利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染
D.氮化硅陶瓷是一种新型无机非金属材料
-
下列说法错误的是( )
A.为了实现“环保世博”的目标,世博会广场外安装催化光解设施,可将汽车尾气转
化为无毒气体
B.生铁、碳素钢都是合金材料,合成纤维、光导纤维都是有机高分子材料
C.哥本哈根气候大会倡导“低碳经济”,使用太阳能等代替化石燃料,可减少温室气
体的排放
D.饮用牛奶和豆浆可以缓解重金属引起的中毒
-
下列说法错误的是( )
A.为了实现“环保世博”的目标,世博会广场外安装催化光解设施,可将汽车尾气转化为无毒气体
B.生铁、碳素钢都是合金材料,合成纤维、光导纤维都是有机高分子材料
C.哥本哈根气候大会倡导“低碳经济”,使用太阳能等代替化石燃料,可减少温室气体的排放
D.饮用牛奶和豆浆可以缓解重金属引起的中毒