-
近代化学工业的基础是“三酸两碱”,早在我国古代就已经有人通过煅烧绿矾并将产生的气体溶于水中的方法制得硫酸,该法制备硫酸的过程中发生的主要反应如下:
反应Ⅰ:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O↑;
反应Ⅱ:SO3+H2O=H2SO4。
下列说法正确的是
A.当生成标准状况下气体22.4L时,转移1mol电子
B.6.4gSO2中所含的质子数与6.4gSO3中所含的质子数相等
C.SO2、SO3的中心原子杂化类型不同
D.目前,工业上制硫酸的吸收阶段是采用浓硫酸吸收SO3
高三化学多选题中等难度题查看答案及解析
-
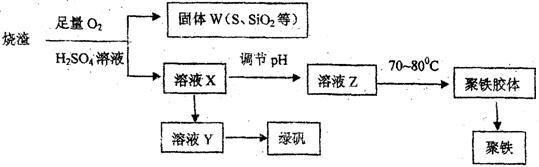
化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如 下:

(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。
(4)在实验室里,完成过程④中的____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有___________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是____________________________________________________。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
高三化学填空题极难题查看答案及解析
-
聚合硫酸铁又称聚铁,化学式为
,广泛用于污水处理。
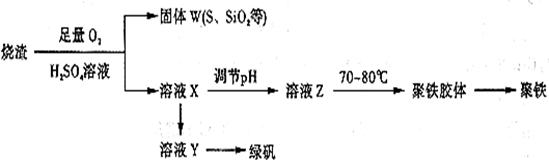
某化学兴趣小组在实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、Si02等)
制备聚铁和绿矾
的过程如下:
(1) 验证固体W焙烧后产生的气体含有SO2的方法是________。
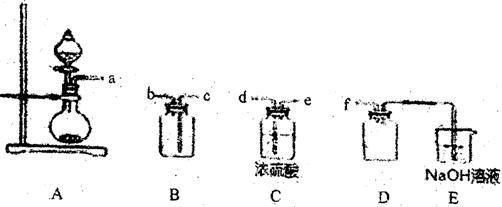
(2) 实验室制各、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各
仪器接口,顺序为a→________→________→________→________→f,装置D的作用是________,装置E中NaOH溶液的作用是________。
(3) 制备绿矾时,内溶液X中加入过量________,充分反应后,经________
操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用PH试纸测定溶渡pH的操作方法为________
________。
高三化学实验题中等难度题查看答案及解析
-
聚合硫酸铁又称聚铁,化学式
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是 _________________________
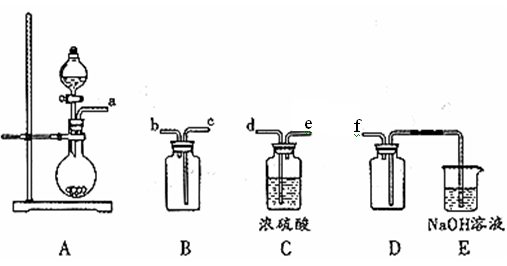
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a
_____
_____
_____
_____
f(填接口字母)。装置D的作用是__________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)若取m g制得的绿矾样品溶于水加入足量BaCl2溶液充分反应,过滤、洗涤、干燥,最终得n g BaSO4沉淀,则该绿矾含FeSO4·7H2O的质量分数为________(用含m、n代数式表示)。
(5)溶液Z的pH影响聚铁中铁的质量分数,要测定溶液Z的pH,除了需要溶液Z、pH试纸、表面皿、玻璃棒等仪器、药品外,还需要的一种仪器或药品是_____________________。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____(大或小) 。
高三化学实验题中等难度题查看答案及解析
-
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
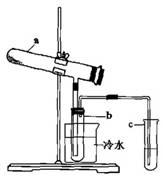
①试管b中得到的主要产物是________,检验该产物的方法是(结合离子方程式简要说明)。
②为检验反应的另一种生成物,试管c中应加入的试剂是________,简述相应的实验现象及结论________。
③ 所得硫酸的理论浓度(溶质的质量分数)为________。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
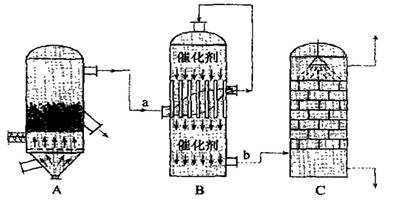
①图中设备A的名称是________,a、b两处所含气体的化学式分别为、________。
②有关接触法制硫酸的下列说法中,不正确的是________。
A. 二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:① 生产成本低、② 原料易得、③________、④________、⑤________、⑥________(可不填满)。
高三化学实验题简单题查看答案及解析
-
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO4∙7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
高三化学计算题中等难度题查看答案及解析
-
绿矾(FeSO4•7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3•nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO4•7H2O。
(4)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
高三化学计算题困难题查看答案及解析
-
绿矾(FeSO4•7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3•nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO4•7H2O。
(4)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
高三化学计算题困难题查看答案及解析
-
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为________(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围________;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
高三化学填空题困难题查看答案及解析
-
工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾.
(1)若用98% 1.84g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:________.
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00g铁粉充分反应,收集到224mL(标准状况)气体,剩余固体质量为3.88g,测得反应后的溶液中Fe2+的物质的量为0.14mol(不含Fe3+).则该样品中Fe2+离子的氧化率为________.
(3)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.现取0.4g Cu2S和CuS的混合物在酸性溶液中用40mL 0.150mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2mol/L (NH4)2Fe(SO4)2溶液完全反应.已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)①V的取值范围为________;②若V=35,试计算混合物中CuS的质量分数.高三化学填空题中等难度题查看答案及解析