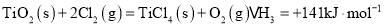-
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
①试管b中得到的主要产物是________,检验该产物的方法是(结合离子方程式简要说明)。
②为检验反应的另一种生成物,试管c中应加入的试剂是________,简述相应的实验现象及结论________。
③ 所得硫酸的理论浓度(溶质的质量分数)为________。
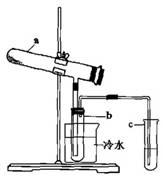
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
①图中设备A的名称是________,a、b两处所含气体的化学式分别为、________。
②有关接触法制硫酸的下列说法中,不正确的是________。
A. 二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:① 生产成本低、② 原料易得、③________、④________、⑤________、⑥________(可不填满)。
-
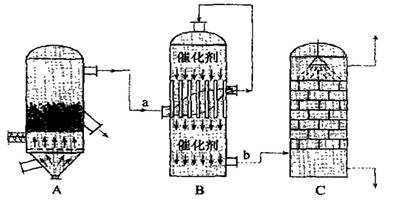
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
-
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
2FeSO4•7H2O  Fe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )
Fe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )

A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42-
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
-
硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2+11O2  2Fe2O3+8SO2;该反应中氧化剂和氧化产物的物质的量之比为______;标准状态下得到4.48升SO2时,一共转移了______mole-.
2Fe2O3+8SO2;该反应中氧化剂和氧化产物的物质的量之比为______;标准状态下得到4.48升SO2时,一共转移了______mole-.
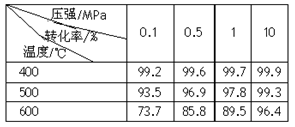
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:
压强/MPa
转化率/%
温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
根据上表回答,SO2转化到SO3的最佳反应条件是______.
A.400-500℃0.1MPa B.400℃10MPa
C.500℃10MPa D.400-500℃1MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:______.若在该条件下将2mol SO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为______ (用含Q1、Q2代数式表示).
(4)市售浓硫酸的密度是1.84g/cm3、质量分数为98%,若用H2SO4•XH2O来表示这种浓硫酸,则X为______.
-
(14分) 硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
该反应中氧化剂和氧化产物之比为 ________;标准状态下得到4.48升SO2 时,一共转移了 ________mol e- 。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是________。(每空2分)
A.400-500℃ 0.1 MPa B.400℃ 10 MPa
C.500℃ 10 MPa D.400-500℃ 1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:________。若在该条件下将2 mol SO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为________ (用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为________ 。(每空2分)
-
近代化学工业的基础是“三酸两碱”,早在我国古代就已经有人通过煅烧绿矾并将产生的气体溶于水中的方法制得硫酸,该法制备硫酸的过程中发生的主要反应如下:
反应Ⅰ:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O↑;
反应Ⅱ:SO3+H2O=H2SO4。
下列说法正确的是
A.当生成标准状况下气体22.4L时,转移1mol电子
B.6.4gSO2中所含的质子数与6.4gSO3中所含的质子数相等
C.SO2、SO3的中心原子杂化类型不同
D.目前,工业上制硫酸的吸收阶段是采用浓硫酸吸收SO3
-
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
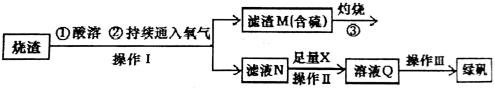
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中, 溶液不会褪色的是___________
溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、  、干燥。
、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
-
还原铁粉是粉末冶金工业的重要原料,利用生产钛白的副产品绿矾制备还原铁粉的工业流程如下:
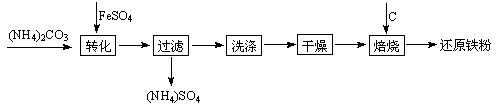
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
-
二氧化钛是制取航天航空工业钛合金的重要原料.用钛铁矿 主要成分是钛酸亚铁
主要成分是钛酸亚铁 ,含少量
,含少量 、MgO、
、MgO、 等杂质
等杂质 作原料生产金属钛和绿矾
作原料生产金属钛和绿矾 等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以
等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以 无色
无色 、
、 紫色
紫色 形式存在.
形式存在.
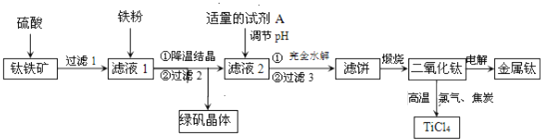
请回答下列问题:
 硫酸与
硫酸与 反应生成
反应生成 的化学方程式是______.
的化学方程式是______.
 滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
已知:氧化性: 则加入铁粉的作用是______.
则加入铁粉的作用是______.
 滤液2中加入适量的试剂A,可选用______
滤液2中加入适量的试剂A,可选用______ 填编号
填编号 .
.
 稀
稀 通入
通入 鼓入空气
鼓入空气
 已知
已知 ,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
 ,
,
 ,
,
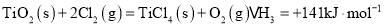
反应 ______.
______.
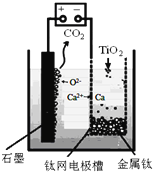
 用石墨作阳极、钛网作阴极、熔融
用石墨作阳极、钛网作阴极、熔融 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
 假如
假如 中的铁元素占矿物中铁元素总量的
中的铁元素占矿物中铁元素总量的 ;某次生产中,向滤液1中加入纯铁粉为b kg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为
;某次生产中,向滤液1中加入纯铁粉为b kg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为 ,Ti元素的转化率为
,Ti元素的转化率为 ,其他损失忽略不计.按上述流程,得到
,其他损失忽略不计.按上述流程,得到 ______
______ 用数字和字母表示
用数字和字母表示 已知:
已知:
-
硫酸是工业生产中重要的产品之一,以黄铁矿为原料生产硫酸的简单流程如下图所示。

请填写下列空白。
(1)黄铁矿燃烧生成SO2的化学方程式为_____________;接触室中发生反应的化学方程式为____________________。
(2)为充分利用反应放出的热量,接触室中应安装_____________(填设备名称);吸收塔中填充有许多瓷管,其作用为__________________。
(3)为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为____________________(设空气中氧气的体积分数为0.20);将上述炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为________________%。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式为___________________。
(5)硫酸的用途非常广泛,可应用于下列____________(可多选)。
a.橡胶的硫化 b.过磷酸钙的制备
c.铅蓄电池的生产 d.表面活性剂“烷基苯磺酸钠”的合成
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。