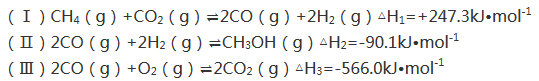-
CO在工农业生产中有着重要的应用。
(1)CO是制备很多有机物(如甲醇、乙醇、甲醚等)的原料,现用CO与H2合成甲醇,反应如下:CO(g)+2H2(g)= CH3OH(g) △H=-99kJ•mol–1。
①已知断裂1molCO(g)中的化学键消耗的能量为1072kJ,断裂1molH2(g)中的化学键消耗的能量为436kJ,则形成1molCH3OH(g)中化学键释放的能量为_____。
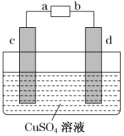
②用CH3OH 燃料电池电解精炼粗铜,装置如图所示。当消耗1mol甲醇时,d极质量增加了160g,则甲醇应加入____(填“a”或“b”)极,该电池的能量转化率为________(保留3位有效数字)。
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g) Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的 倍。则:
倍。则:
①0~10min内平均反应速率v(Ni)=________g•min–1。
②研究表明正反应速率v正=k正•x4(CO),逆反应速率v逆 =k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),则T0温度下, =_____。
=_____。
③当温度升高时k正_______k逆(填“大于”“小于”或“等于”),此时CO的转化率___________(填“变大”“变小”或“不变”)。
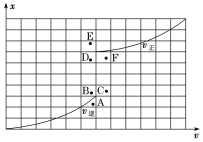
④T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系可用如图进行表示。当降低温度时,反应重新达到平衡,相应的点分别为______、______。
-
(18分)甲醇是一种重要的化工原料,在生产中有着重要应用。工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应(下列焓变数据均在25℃测得):
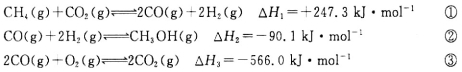
(1)25℃时,用CH4和O2直接制备甲醇蒸气的热化学方程式为________________;
(2)某温度下,向容积为4 L的恒容密闭容器中通入6 molCO2和6 mol CH4,发生反应①,5 min后反应在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5 min内的平均反应速率v(CO)=________mol·L-1·min-1;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数________(填“增大”“不变”或“减小”);
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,25℃时,其反应的热化学方程式为:
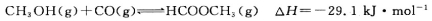
科研人员对该反应进行了研究,部分研究结果如下图所示:
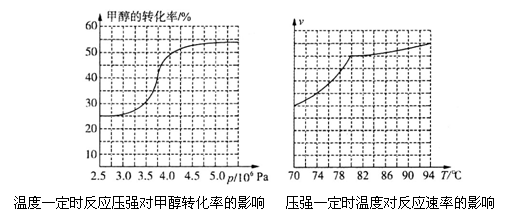
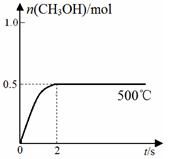
①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸甲酯应选择的是_______(填下列序号字母)
a.3.5×106Pa b.4.0×l06Pa c.5.0×106Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是______________
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
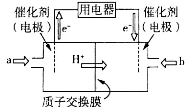
①通入气体a的电极是电池的_____(填“正”或“负”)极,其电极反应式为__________;
②25℃时,用此电池以石墨作电极电解0.5 L饱和食盐水(足量),若两极生成的气体共1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液体积的变化)。
-
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
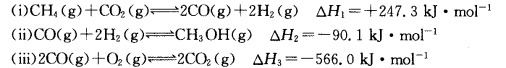
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
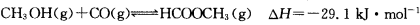 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
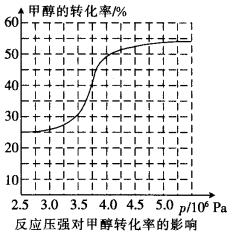
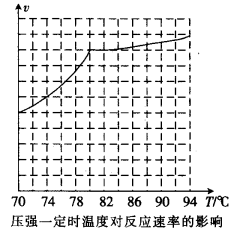
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
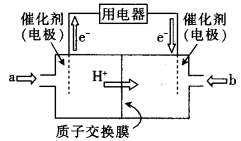
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
-
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
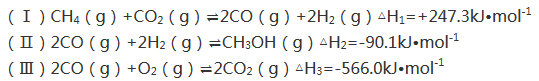
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向容积为4 L的容器通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反 应”或“逆反应”)方向移动。
应”或“逆反应”)方向移动。
-
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
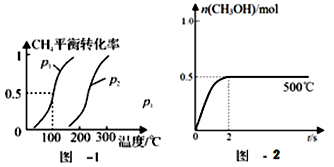
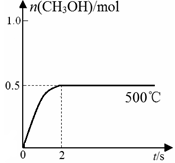
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
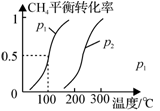
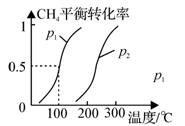
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
-
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图1所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图2所示。
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在图2中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)
科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
-
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
①应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
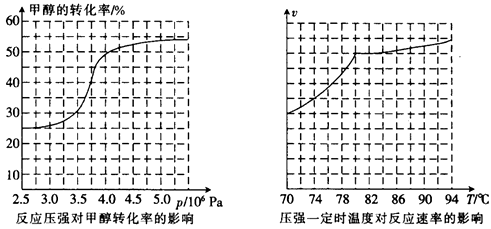
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
-
甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。
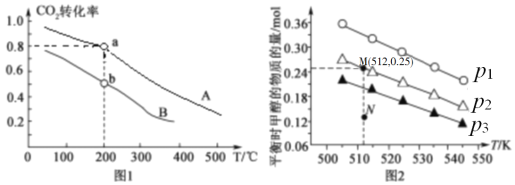
①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)  CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)  C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
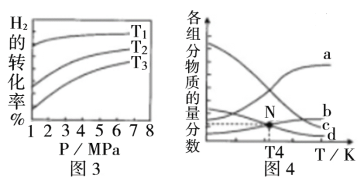
①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。
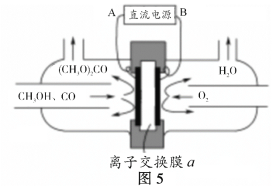
离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
-
乙醇是一种重要的化工原料,在生活、生产中的应用广泛。
(1)工业上利用二甲醚合成乙醇
反应①:CH3OCH3(g) + CO(g)  CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g) + 2H2(g)  CH3OH(g) + C2H5OH(g) △H2
CH3OH(g) + C2H5OH(g) △H2
一定压强下,温度对二甲醚和乙酸甲酯平衡转化率影响如下图1所示,据图示判断,△H2________0(填“>”或“<”)。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如下图2所示。在300K~600K范围内,乙酸甲酯的百分含量逐渐增加,而乙醇的百分含量逐渐减小的原因是_____________。
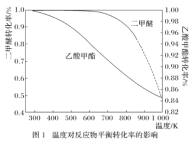
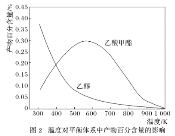
(2)乙醇加入汽油(平均分子式为C8H18)中能改善油品质量,减少对环境的影响。
①乙醇汽油可提高燃油的燃烧效率,减少CO等不完全燃烧产物的生成。相同条件下,等物质的量的乙醇与汽油完全燃烧消耗氧气之比为_____________。

②NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag−ZSM−5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________;在 =1的条件下,应控制的最佳温度在_____________左右,写出此条件下发生反应的化学方程式_____________。
=1的条件下,应控制的最佳温度在_____________左右,写出此条件下发生反应的化学方程式_____________。
(3)某乙醇燃料电池采用碱性介质,该电池工作时负极的电极反应式为____________。
-
乙醇是一种重要的化工原料,在生活、生产中的应用广泛。
(1)工业上利用二甲醚合成乙醇
反应①:CH3OCH3(g) + CO(g) CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g) + 2H2(g) CH3OH(g) + C2H5OH(g) △H2
CH3OH(g) + C2H5OH(g) △H2
一定压强下,温度对二甲醚和乙酸甲酯平衡转化率影响如图所示,则△H1
_____________0(填“>”或“<”,下同)、△H2_____________0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图所示。在300 K~600 K范围内,乙酸甲酯的百分含量逐渐增加,乙醇的百分含量逐渐减小的原因是_____________。
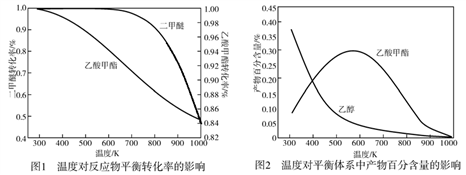
(2)乙醇加入汽油(平均分子式为C8H18)中能改善油品质量,减少对环境的影响。
①乙醇汽油可提高燃油的燃烧效率,减少CO等不完全燃烧产物的生成。相同条件下,等物质的量的乙醇与汽油完全燃烧消耗氧气之比为_____________。
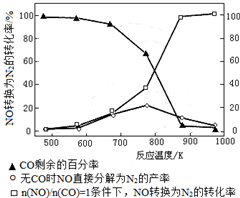
②NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag−ZSM−5为催化剂,测得NO转化为N2的转化率随温度变化情况如右图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________;在 =1的条件下,应控制的最佳温度在_____________左右。写出此条件下发生反应的化学方程式:_____________。
=1的条件下,应控制的最佳温度在_____________左右。写出此条件下发生反应的化学方程式:_____________。
(3)某乙醇燃料电池采用质子(H+)溶剂,在200℃左右供电的电池总反应为C2H5OH+3O2  2CO2+3H2O。该电池负极的电极反应式为_____________。
2CO2+3H2O。该电池负极的电极反应式为_____________。

Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
倍。则:
=_____。

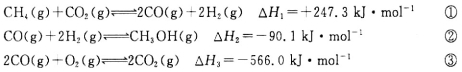
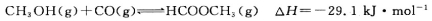


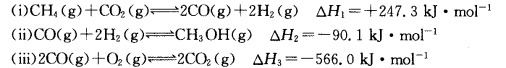
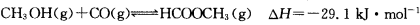 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下: