-
某温度下,在起始压强为80kPa的刚性容器中,发生NO的氧化反应:2NO(g)+O2(g)⇌2NO2(g) △H,该反应的反应历程分两步进行,其速率方程和反应过程中能量变化如下:
①2NO(g)⇌N2O2(g) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)⇌2NO2(g) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
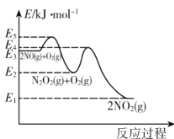
下列说法正确的是
A.NO氧化反应速率快慢的决定步骤的活化能是E5—E3
B.一定温度下,2NO(g)+O2(g)⇌2NO2 (g)平衡常数表达式K=
C.升高温度,NO氧化反应的化学平衡向逆反应方向移动
D.该温度下,将等物质的量的NO和O2混合反应(忽略2NO2⇌N2O4),NO的平衡转化率为40%时,该反应的平衡常数Kp= kPa-1
kPa-1
-
(11分)某条件下,在2L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
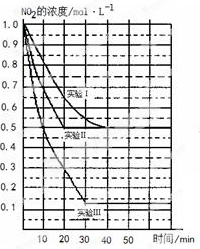
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将 _________(填“正向移动”或“逆向移动”或“不移动”)
_________(填“正向移动”或“逆向移动”或“不移动”)(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ ________。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ ________。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应________ ________。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
-
(12分)某条件下,在2L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
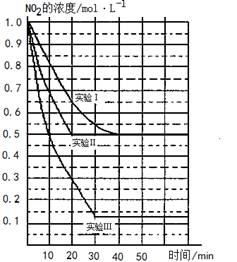
请回答下列问题:
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将_________(填“正向移动”或“逆向移动”或“不移动”)
(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ ________。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ ________。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应________ ________。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
-
温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
| 容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) |
| c(NO2) | c(NO) | c(O2) | c(O2) |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
A.容器Ⅰ中发生反应的平衡常数为0.8 B.容器Ⅱ中发生反应的起始阶段有v正>v逆
C.达到平衡时,容器Ⅲ中 >1 D.达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
>1 D.达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
-
温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2  2NO+O2(正反应吸热)。实验测得:
2NO+O2(正反应吸热)。实验测得: ,
,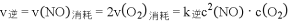 ,
, 为速率常数,受温度影响。 下列说法正确的是
为速率常数,受温度影响。 下列说法正确的是
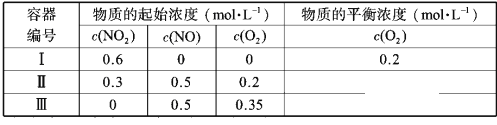
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器Ⅱ中 比容器Ⅰ中的大
比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中 的体积分数大于50%
的体积分数大于50%
D. 当温度改变为 时,若
时,若 ,则
,则 
-
一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g)  2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
-
(13分)某条件下,在2 L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
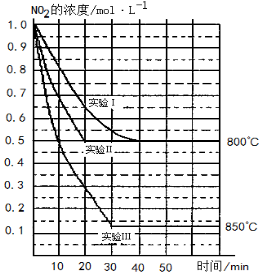
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= ,该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),此时反应将向 进行(填“正反应方向”或“逆反应方向”)。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,
如:8NH3+6NO2  7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7 ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7 ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。














-
某条件下,在2 L密闭容器中发生如下反应:2NO2 (g) 2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
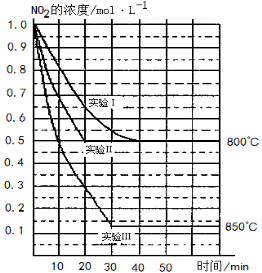
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡时NO2浓度减少了0.5mol/L,则根据方程式可知生成氧气是0.25mol/L,因此用氧气浓度变化表示的化学反应速率为0.25mol/L÷20min= 。
(3)800℃时,该反应的平衡常数K= 。该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体 (保持温度不变),此时平衡将向 移动 (填“正反应方向”或“逆反应方向”),你判断的依据是 。
(5)NO2、NO是重要的大 气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2
气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
-
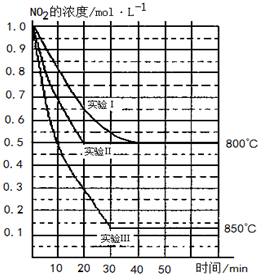
某条件下,在2L密闭容器中发生如下反应2NO2(g)⇌2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题:
在2L密闭容器内,800℃时反应:2NO2(g)⇌2NO(g)+O2(g)体系中,n(NO2)随时间的变化如表:
(1)实验Ⅱ隐含的反应条件是______
(2)写出该反应的平衡常数表达式:K=______.该反应是______(填“吸”或“放”)热反应.
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),则平衡将______移动.
(4)若将上述第(3)题所得的平衡混和气体通入足量的NaOH溶液中,使气体被充分吸收.生成的产物及其物质的量为______.
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,该反应的化学方程式为______.(任写一个)
-
某条件下,在2 L密闭容器中发生如下反应2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
在2L密闭容器内,800℃时反应:2NO2(g) 2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表:
2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表:
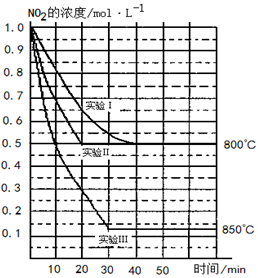
⑴实验Ⅱ隐含的反应条件是________
⑵写出该反应的平衡常数表达式: K=________。
该反应是________(填“吸” 或“ 放”)热反应。
⑶若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),则平衡将________移动。
⑷若将上述第⑶题所得的平衡混和气体通入足量的NaOH溶液中,使气体被完全吸收。
生成的产物及其物质的量为________。
⑸NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转
化为无害的参与大气循环的物质,该反应的化学方程式为________。
(任写一个)

kPa-1


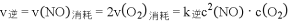 ,
,




