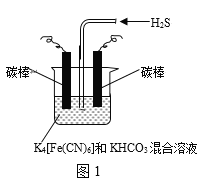
-
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
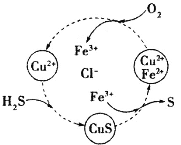
A.在转化过程中化合价不变的元素只有Cu和Cl
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
-
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
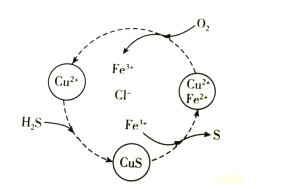
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2 2S+2H2O
2S+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的物质的量为0.5mol
-
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
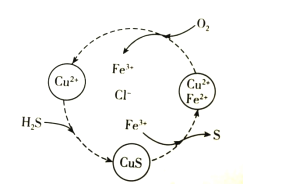
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2 2S+2H2O
2S+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的物质的量为0.5mol
-
硫化氢的转化是资源利用和环境保护的重要研究课题。下列关于硫化氢的说法错误的是
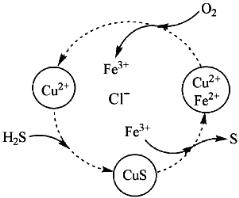
A.H2S是一种弱电解质
B.可用石灰乳吸收H2S气体
C.根据右图可知FeCl3、CuCl2均能氧化H2S
D.H2S在空气中燃烧可以生成SO2
-
将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是( )
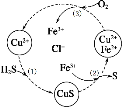
A.在图示的转化中,化合价不变的元素只有铜
B.由图示的转化可得出氧化性的强弱顺序:O2>Fe3+>S
C.在图示的转化中,发生的反应有:H2S+Cu2+=CuS↓+2H+
D.在图示的转化中,发生的反应有:4Fe2++O2+2H2O=4Fe3++4OH-
-
用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图。下列有关说法错误的是
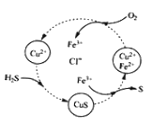
A.氢、氯、铜三元素的化合价未发生改变
B.转化过程中包含三步化学反应
C.转化过程中还原剂为H2S和FeCl2
D.总反应可表示为:2H2S+O2→ 2S+2H2O
-
硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS)。羰基硫可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。反应方程式为:
CO(g)+H2S(g) COS(g)+H2(g)
COS(g)+H2(g)
①羰基硫的电子式为_________其含有的共价键类型是________共价键。
②下列能说明碳与硫两元素非金属性相对强弱的是_____________。
a.相同条件下水溶液的pH:Na2CO3 > Na2SO4
b.酸性:H2SO3 > H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式__________________。
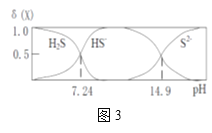
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
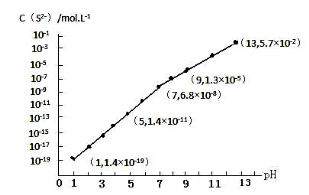
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
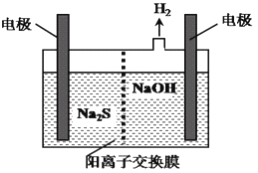
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
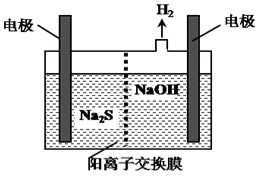
S2--2e-=S↓ (n-1)S+S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式:______________________。
②Na2S溶液中离子浓度由大到小顺序:________________________。
-
Ⅰ 硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为__________。
②下列能说明碳与硫两元素非金属性相对强弱的是_______(填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
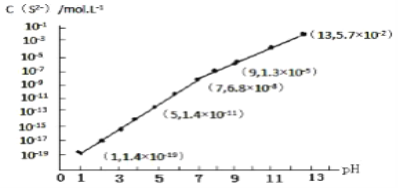
①pH=13时,溶液中的c(H2S)+c(HS-)=______ mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=_______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
Ⅱ.降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
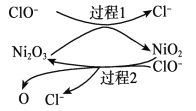
ii.过程 1 的离子方程式是__________。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
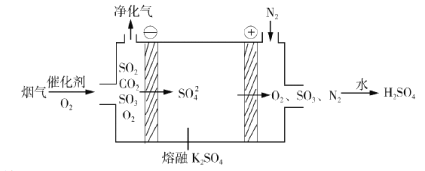
i.在阴极放电的物质是______。
ii.在阳极生成 SO3的电极反应式是______。
-
硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为__________。
②下列能说明碳与硫两元素非金属性相对强弱的是_______(填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
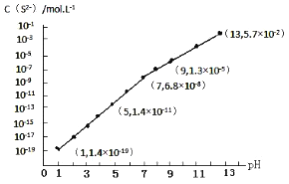
①pH=13时,溶液中的c(H2S)+c(HS-)=______ mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=_______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2--2e-=S↓ (n-1)S+S2- Sn2-写出电解时阴极的电极反应式:______________________。
Sn2-写出电解时阴极的电极反应式:______________________。
(5)一定温度下将NH4HS固体放入定容真空密闭容器中,可部分分解为硫化氢和氨气:NH4HS(s) H2S(g)+NH3(g)。
H2S(g)+NH3(g)。
①可以判断上述分解反应已经达到化学平衡状态的是_______ (填字母代号)
A.v(H2S)=v(NH3) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②当上述反应达平衡时:p(NH3)×p(H2S)=a(Pa2),则平衡时容器中的总压为_______Pa( 用含a 的代数式表示).[p(NH3)、p(H2S)分别代表NH3、H2S的压强,Pa为压强的单位]
-
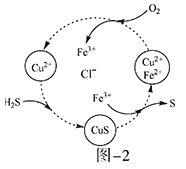
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
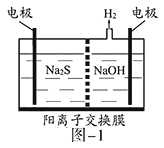
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是___________。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为_______________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________________。
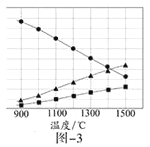
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为_____________。
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
转化为HCO
。通H2S发生反应的离子反应方程式为___。