-
铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
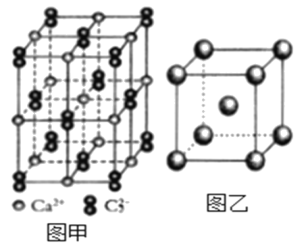
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
-
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关四环素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| 1 | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| 2 | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| 3 | ___ | 7 | 60 | ___ | ___ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
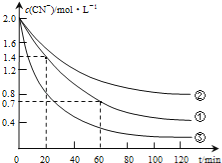
(2)实验①中20~60min时间段反应速率:υ(CN-)=___mol•L-1•min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是__(填一点即可),在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式___。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(己知:废水中的CN-浓度可用离子色谱仪测定)___
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
-
(10分)某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾
(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。

(1)开始时,接通K电键:U形管中无沉淀,可知电源正极为 (填“a”或“b”).Fe电极上发生的电极反应为 。
(2)断开K电键,V形管中为将 能转化为 能的装置;U形管A端现象为 。
-
某电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
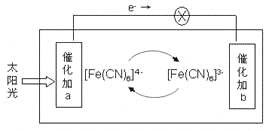
A. K+移向催化剂b
B. 催化剂a表面发生的化学反应:[Fe(CN)6]4- - e- = [Fe(CN)6]3-
C. [Fe(CN)6]3-在催化剂b表面被氧化
D. 电解质溶液中的[Fe(CN6)]4-和[Fe(CN6)]3-浓度基本保持不变
-
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
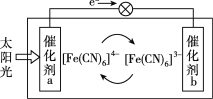
A. K+移向催化剂b
B. 催化剂a表面发生的化学反应:[Fe(CN)6]4--e-===[Fe(CN)6]3-
C. [Fe(CN)6]3-在催化剂b表面被氧化
D. 电解质溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变
-
已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是
2Fe2++I2”的是
| 实验编号 | 实验操作 | 实验现象 |
| 滴入KSCN溶液 | 溶液变红色 |
| 滴入AgNO3溶液 | 有黄色沉淀生成 |
| 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
-
已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是
2Fe2++I2”的是
| 实验编号 | 实验操作 | 实验现象 |
| 滴入KSCN溶液 | 溶液变红色 |
| 滴入AgNO3溶液 | 有黄色沉淀生成 |
| 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
-
碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
(1)K3[Fe(CN)6]中Fe3+与CN-之间的作用为___,该化学键能够形成的原因是___。
(2)某有机物的结构简式为 。该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为___。
。该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为___。
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___。
(4)NH4Cl中阳离子中心原子的价层电子对数为___,该物质中不含有___。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.σ键 F.π键
(5)NCl3的立体构型为___,其中心原子的杂化轨道类型为___。
-
(12分)
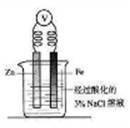
1.下图为牺牲阳极的阴极保护法的实验装置,此装置 中Zn电极上的电极反应为;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是________,发生的反应的离子方程式是________。
2.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I- = 2CuI↓ + I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。①电解开始不久,阴极产生的实验现象有________,阴极的电极反应是________。
②阳极区溶液变蓝色,同时伴随的现象还有________,对阳极区溶液
呈蓝色的正确解释是________。
A. 2I- - 2e- = I2 ;碘遇淀粉变蓝
B. Cu - 2e- = Cu2+;Cu2+显蓝色
C. 2Cu + 4I-- 4e- = 2CuI↓ + I2; 碘遇淀粉变蓝
D. 4OH-- 4e- = 2H2O + O2 ;O2将I-氧化为I2,碘遇淀粉变蓝
-
下列说法不正确的是( )
A. 一般来说,不纯的金属与电解质溶液接触时,会发生原电池反应
B. 溶液中Fe2+ 可以用K3[Fe(CN)6]溶液来检测
C. 铁锈覆盖在钢铁表面,阻止钢铁继续腐蚀
D. 在船身上装锌块来避免船体遭受腐蚀







