-
25℃时,0.lmol/L的HA溶液中 =1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是_______ 。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=____mo l/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是____ (填字母)。
A.  B.
B.  C. c(H+)与c(OH-)的乘积 D.c(OH-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(4)将等体积等物质的量浓度的HA 溶液和BOH 溶液混合后的溶液呈________性,请用离子方程式解释其原因______________________。
(5)常温下pH=12 的BOH 溶液100mL,加0.01mol/LNaHSO4,使溶液的pH 为11。(混合溶液体积变化忽略不计),应加NaHSO4________mL。 (保留到小数点后一位)
-
25℃时,0.lmol/L的HA溶液中 =1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是_______ 。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=____mo l/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是____ (填字母)。
A.  B.
B.  C. c(H+)与c(OH-)的乘积 D.c(OH-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(4)将等体积等物质的量浓度的HA 溶液和BOH 溶液混合后的溶液呈________性,请用离子方程式解释其原因______________________。
(5)常温下pH=12 的BOH 溶液100mL,加0.01mol/LNaHSO4,使溶液的pH 为11。(混合溶液体积变化忽略不计),应加NaHSO4________mL。 (保留到小数点后一位)
-
25℃时,0.1mol/L的HA溶液中  =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是________。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=________mol/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A. B.
B. C.c(H+)与c(OH﹣)的乘积 D. c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D. c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈________性,请用离子方程式解释其原因_______________________,混合溶液中各离子浓度由大到小的顺序是_______________________。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加 NaHSO4________mL。(保留到小数点后一位)
-
25℃时,0.1 mol/L的HA溶液中 =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.
B.
C.c(H+)与c(OH-)的乘积
D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
-
25℃时,0.1 mol/L的HA溶液中 =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.
B.
C.c(H+)与c(OH-)的乘积
D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
-
25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是_______。
(2)HA的电离方程式是____________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
-
Ⅰ.25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。
(1)HA是_____(填“强电解质”或“弱电解质”,下同),BOH是____。
(2)HA的电离方程式是____、BOH的电离方程式是______。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_____(填字母)。
A. B.
B. C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体____(填“多”、“少”或“相等”)。
Ⅱ. 在25 ℃时,请进行有关计算:(已知lg2=0.3)
(5)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水___mL;如果加入pH=4的HCl溶液,需加入此HCl溶液____ mL(假定溶液体积有加和性,下同)。
(6)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=____。
(7)将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=_____。
(8)pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____。
-
25℃时,物质的量浓度均为0.01 mol·L-1 的HA和BOH溶液,pH分别为3和12,将物质的量浓度相等两溶液等体积混合后,所得溶液的pH
A. 可能等于7 B. 一定<7 C. 一定>7 D.无法判断
-
(12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
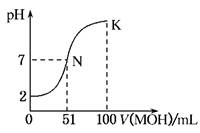
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分)
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。(4分)
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________ (2分)
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分)
-
(12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
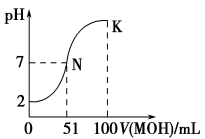
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
=1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
B.
C. c(H+)与c(OH-)的乘积 D.c(OH-)

