-
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积。该小组设计的简单实验装置如图所示:
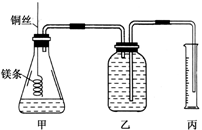
该实验的主要操作步骤如下:
①配制质量分数为36.5%的盐酸(假设其密度为1g/cm3);
②量取10.0mL该盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为___________;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题.
(1)题中涉及反应的化学方程式为___________。
(2)实验步骤⑤中应选用___________(填序号)的量筒.
A.1000mL B.2000mL C.5000mL
读数时除恢复到室温外,还要注意___________;
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ___________,若未除去镁条表面的氧化膜,则测量结果___________(填“偏大”、“偏小”或“无影响”)。
-
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,该小组设计的简易实验装置如图所示。该实验的主要操作步骤如下:
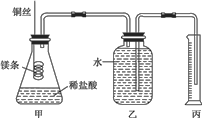
(1)配制溶液:①配制100mL1.0mol·L-1的盐酸,需要20%,密度为1.1g·cm-3的盐酸的体积为______mL
②配制过程中所需要的玻璃仪器有量筒、烧杯、玻璃棒、__________________________________
③下列操作会导致物质的量浓度偏大的是_________________
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
(2)用量筒量取出20.0mL1.0mol·L-1的盐酸加入锥形瓶中;
(3)称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
(4)往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
(5)反应结束后待体系温度恢复至室温,读取量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
①实验步骤(5)中应选用________(填序号)的量筒。
A.100mLB.200mLC.250mLD.2000mL
②读数时除恢复到室温,量筒内的液面与集气瓶内液面相平,还要注意_____________________
③若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算公式为Vm=________。
若未除去镁条表面的氧化膜,则测量结果________(填“偏大”“偏小”或“无影响”)。
-
(10分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。
设计的简易实验装置如图。该实验的主要操作步骤如下:

a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用________________量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为________g;d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录________;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述d检查该装置气密性的操作与观察方法:________。
(2)本实验中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)简述速率不等的原因________,铜丝不与酸接触的原因是________。
-
(12分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。
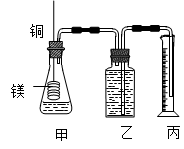
该实验的主要操作步骤如下:
a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用 ①量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ② g;d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录 ③ ;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ④ ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述d检查该装置气密性的操作与观察方法: ⑤ 。
(2)本实验中应选用 ⑥ (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)简述速率不等的原因 ⑦ ,铜丝不与酸接触的原因是 ⑧ 。
-
(12分)某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图所示。该实验的主要操作步骤如下:
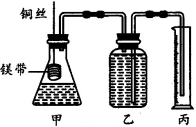
①配制浓度均为l mol·L-1的盐酸和醋酸溶液;
②用________量取10.00 mL l mol·L-1的盐酸和醋酸溶液分别加入到两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝,末端,a的数值至少为___________;
④在广口瓶中装足量的水,按图所示连接好装置,检查装置的气密性。
⑤将铜丝向下移动,使足量镁带浸人酸中(铜丝不与酸接触),至反应完全,记录___________;
⑥反应结束后待温度恢复到室温,调整乙与丙中液面相平,读出量筒中水的体积为V mL。请将上述步骤补充完整并回答下列问题:
(1)本实验中应选用___________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(2)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=_______。
(3)简述速率不等的原因___________,
-
某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
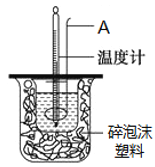
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
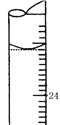
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。
-
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_____。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为_____________。
(4)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(6)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
-
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_____。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为_____________。
(4)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(6)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
-
(10分)某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(其中硅与稀硫酸不反应)测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):
A接( )( )接( )( )接( )

(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?_______________。
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
-
(1)在25℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15:8,则A的摩尔质量为___。
(2)两个相同容积的密闭容器X、Y,在25℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量为___。







