-
(1)把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应: 末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol
末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol  。计算:
。计算:
①前2min内用Y 的浓度变化表示的反应速率为 
②化学方程式中n的值是 。
(2)在一定温度下,将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应,2SO2+O2 2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
(3)某温度时在2L容器中A、B、C 三种气态物质的物质的量(n)随时间(l)变化的曲线如图所示,由图中数据分析:
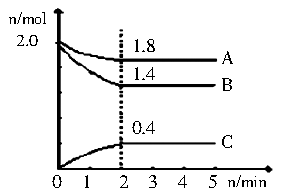
①该反应的化学方程式为
②下列叙述能说明上述反应达到平衡状态的是 。
A、混合气体的总物质的量不随时间的变化而变化
B、相同时间内消耗2n mol 的A的同时生成4nmol 的C
C、混合气体的总质量不随时间的变化而变化
D、容器内压强不再发生变化
-
Ⅰ.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为________;2 min末时Y的浓度为________;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水________g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
-
把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g)。2min时生成0.3mol W,此时测知以Z的浓度变化表示的反应速率为0.05mol•L﹣1•min﹣1。
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?____
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。______
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=________
-
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:4X(g)+5Y(g) ===nZ(g)+6W(g);2 min末生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为___________;2 min末时Y的浓度为______________;化学方程式中n的值是________。
-
(7分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g)。2 min时生成0.3 mol W,此时测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 mol·L-1·min-1。
(2)计算n值和2 min末时Y的浓度(写出必要的计算过程)。
-
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
-
(10分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W (g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol/(L·min),
(1)则这2 min内v(X) =________ v(W) = ________
(2)2 min末时Y的浓度________
(3)化学反应方程式中n的值是________
(4)2min末时,已用去的X占原来总物质的量分数为________
-
把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=n Z(g)+6W(g).2min 末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol•-1,计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
-
把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=n Z(g)+6W(g).2min 末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol•-1,计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
-
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:(写出计算过程)
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol
。计算:
2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
