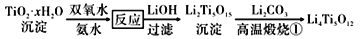-
我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2 等杂质) 经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________。
II.以TiO2 为原料制备金属钛,流程如下: TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
(5)己知碳的燃烧热394kJ/mol,请写出TiO2 与Cl2、C反应制取TiCl4的热化学方程式_____________。
III.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
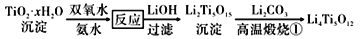
(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O 的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。
-
我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石 、钛铁矿
、钛铁矿 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.

 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出 水解的方程式 ______
水解的方程式 ______
 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、 共热得到
共热得到 的化学方程式: ______
的化学方程式: ______
 ①
① 
②
请写出上图中 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为
 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的
B 在不同温度区域, 的量保持不变
的量保持不变
C 在提纯过程中, 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中, 可循环利用
可循环利用
 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______  填左室、右室
填左室、右室 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______  不考虑生产过程中物质的任何损失
不考虑生产过程中物质的任何损失
-
钪(Sc)是一种典型的稀散元素,具有重要的工业利用价值,从钛尾矿( mSc2O3·nTiO2·xFeO·ySiO2)中提取Sc2O3的流程如下:
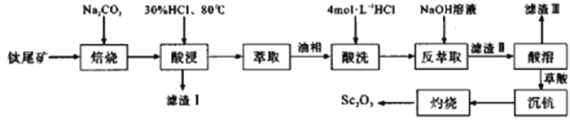
(1)“焙烧”时,为提高焙烧效率,下列措施中无效的是___________(填标号)
a.不断搅拌 b.进一步粉碎固体颗粒 c.增大压强 d.适当升高温度
(2)“酸浸”时,需在80℃条件下进行,则适宜的加热方式为______________________。
(3)“萃取”时,使用伯胺N1923的煤油溶液作为萃取液,萃取率α受振荡时间和萃取剂浓度的影响,椴据下表1和表2数据,萃取时适宜的振荡时间和萃取剂浓度分别为___________min、___________%。
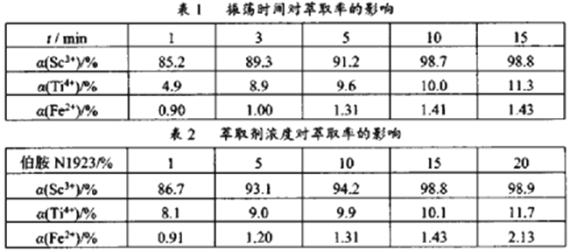
(4)“酸洗”后滤液中存在的金属阳离子有Na+、Sc3+、Ti4+、Fe2+,且浓度均小于0.100mol·L-1,“反萃取”时,加氢氧化钠溶液调节溶液pH=__________时,可使Sc3+沉淀完全(当离子浓度减小至10-5 mol·L-1时,可认为沉淀完全),从滤渣Ⅲ中可以回收的金属元素名称为__________。(已知;lg2=0.3,1g5=0.7;室温下,Ti4+完全沉淀的pH为1.05,Ksp[Fe(OH)2]=4.0×10-17,Ksp[Sc(OH)3]=1.25×10-33)
(5)草酸钪[Sc2(C2O4)3]在空气中“灼烧”的化学方程式为______________________。
(6)若从1吨该钛尾矿中提取得到110.4gSc2O3,则该矿中含钪的质量分数为___________。
-
2017 年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al 等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
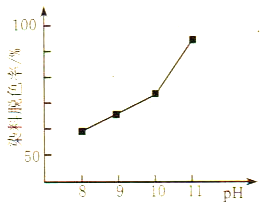
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由: __________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
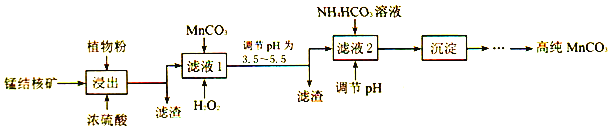
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH 的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS 除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S 气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L 时,Mn2+ 开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
-
资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
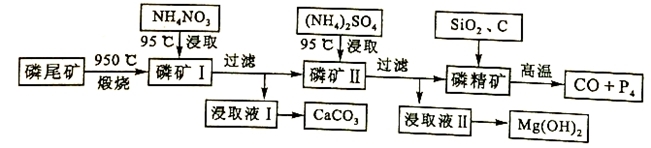
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5 CaO(s)+H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)  CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
-
资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H 2,其简化流程如下:
2,其简化流程如下:
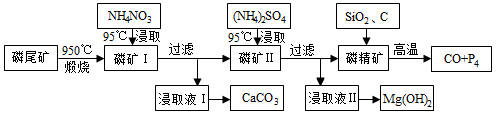
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
 (3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO( s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
-
资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
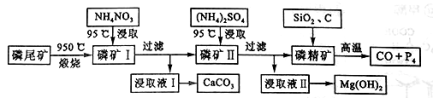
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)  CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
-
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
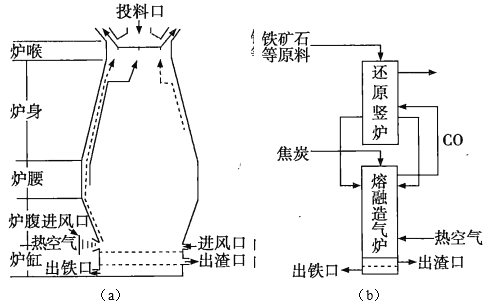
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外还有________。除去铁矿石中脉石(主要成分为 )的化学反应方程式为___________________、_____________________________;高炉排出气体的主要成分有
)的化学反应方程式为___________________、_____________________________;高炉排出气体的主要成分有 、
、 和_________(填化学式)。
和_________(填化学式)。
(2)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的______部分,主要反应的化学方程式为__________________;熔融造气炉相当于高炉的部分。
(3)铁矿石中常含有硫,使高炉气中混有 污染空气,脱
污染空气,脱 的方法是________________________________________________________________。
的方法是________________________________________________________________。
-
铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下:
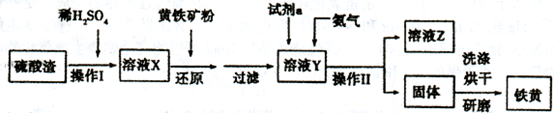
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_________、________
(2)试剂a最好选用_________(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_________。
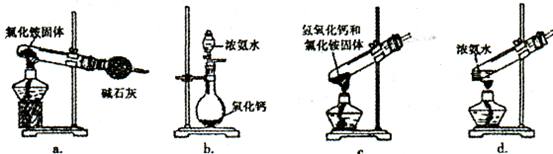
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是__________(填序号)。
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4 、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。
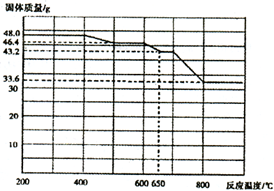
| 加入试剂 | 现象 | 结论 |
| | 则还原产物为________ |
-
铬是一种重要的金属元素,具有多种价态,单质铬是硬度最大的金属,熔点为 。回答下列问题:
。回答下列问题:
 工业上以铬铁矿
工业上以铬铁矿 主要成分是
主要成分是 为原料冶炼铬的流程如图所示:
为原料冶炼铬的流程如图所示:

 中铬元素的化合价为_________。
中铬元素的化合价为_________。
 高温氧化时发生反应的化学方程式为________________。
高温氧化时发生反应的化学方程式为________________。
 操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
 是两性氢氧化物,请写出其电离方程式_________________。
是两性氢氧化物,请写出其电离方程式_________________。
 铬元素能形成含氧酸及含氧酸盐,若测得浓度为
铬元素能形成含氧酸及含氧酸盐,若测得浓度为 的铬酸
的铬酸 溶液中含铬元素的微粒浓度分别为
溶液中含铬元素的微粒浓度分别为 、
、 、
、 ,试推测
,试推测 溶液呈________
溶液呈________ 填“酸”“碱”或“中”
填“酸”“碱”或“中” 性,原因是______________。
性,原因是______________。
 水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
 电解处理含有
电解处理含有 的污水:用铁作电极电解污水,
的污水:用铁作电极电解污水, 被阳极区生成的离子还原成
被阳极区生成的离子还原成 ,生成的
,生成的 与阴极区生成的
与阴极区生成的 结合生成
结合生成 沉淀而除去。则阴极上的电极反应式为_______,若要处理
沉淀而除去。则阴极上的电极反应式为_______,若要处理 浓度为
浓度为 的污水,理论上需要消耗_______kg的铁。
的污水,理论上需要消耗_______kg的铁。
 转化为有价值的产品磁性铁铬氧体
转化为有价值的产品磁性铁铬氧体 :先向含
:先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气 氧化部分
氧化部分 并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式__________,若处理含
的离子方程式__________,若处理含 不考虑其他含铬微粒
不考虑其他含铬微粒 的污水时恰好消耗
的污水时恰好消耗 ,则当铁铬氧体中
,则当铁铬氧体中 时,铁铬氧体的化学式为_______________。
时,铁铬氧体的化学式为_______________。