-
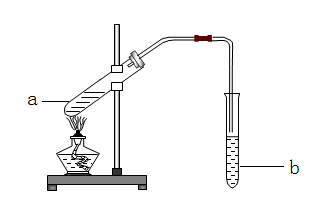
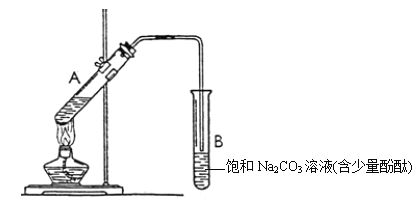
下图为实验室制备乙酸乙酯的装置。

 已知下列数据:
已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | | 338 | 1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。
 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。
 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
-
已知下列数据:
| 物 质 |  熔点/℃ 熔点/℃
| 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | | 338 | 1.84 |
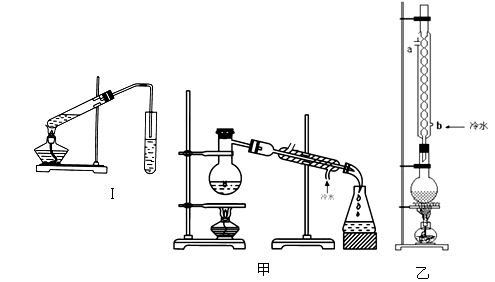
实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯。
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是 。
(2)写出该反应的化学方程式 。浓H2SO4的作用是 。
(3)步骤③中,用小火加热试管中的混合液,其原因是: 。
(4)步骤④所观察到的现象 ,写出原因是_______________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从_______口倒出,因为______________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为 装置合理,因为 。
-
已知下列数据:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | | 338 | 1.84 |

实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛15mL饱和Na2CO3溶液(加入1滴酚酞试液)试管上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)写出CH3COOH和CH3CH218OH反应的化学方程式_____
浓H2SO4的作用是__ _ ____ __
(2)步骤③中,用小火加热试管中的混合液,其原因___ _____
(3)步骤④所观察到的现象是_________________
(4)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出。
(5)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置更合理,为什么?
答:________
-
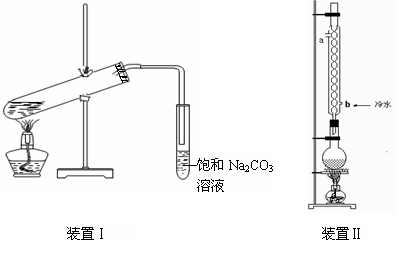
(9分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 98%H2SO4 | 10 | 338 | 1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式,浓H2SO4的作用是。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入________(填仪器名称),用力振荡,静置,________(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:。
-
已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
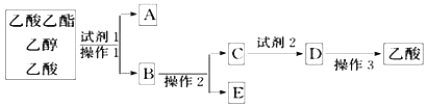
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
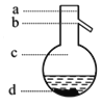
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。

-
已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
如图为实验室制取乙酸乙酯的装置图。
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热。取下小试管B,充分振荡,静置。振荡前后的实验现象为___(填字母)
A.上层液体变薄 B.下层液体红色变浅或变为无色
C.有气体产生 D.有果香味
(2)下图分离乙酸乙酶、乙醇、乙酸的混合物,可按下列步骤进行分离:
①试剂1最好选用________;
②操作1是_______,所用的主要仪器名称是________;
③试剂2最好选用_______;
④操作2是_______;
⑤操作3中温度计水银球的位置应为图中______(填“a”“b”“c”或“d”)所示。
-
已知下列数据:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78.4 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | | 338 | 1.84 |
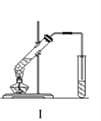
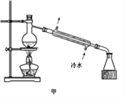

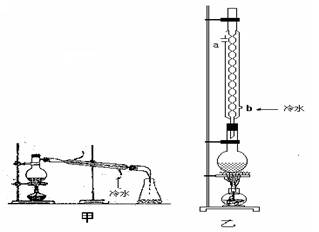
实验室制取乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛有10mL饱和Na2CO3溶液的(加入2滴酚酞试液)试管中;③小火加热试管中的混合液;④待小试管中收集约2mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_____________________________;
(2)写出该实验制取乙酸乙酯的化学方程式_________________________________,浓H2SO4的作用是 _______________________;
(3)步骤③中,用小火加热试管中的混合液,其原因_________________________;
(4)步骤④所观察到的现象是___________________________________________________
(5)步骤⑤中,分离出乙酸乙酯的方法是_________________________________;
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取圆底烧瓶中产物)。你认为哪种装置更合理,为什么?_____。
-
已知下列数据:
| 物质 | 熔点(℃) | 沸点(℃) | 密度 |
| 乙 醇 | —117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | —83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | —— | 338.0 | 1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按下图1连接好装置,用小火均匀地加热装有混合溶液的大试管5~10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
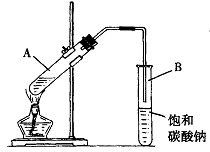
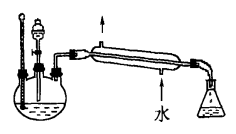
图1 图2
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:___________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)杂质; 为了干燥乙酸乙酯可选用的干燥剂为:______ __。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,该装置的主要优点有(任写2点):
_____________________________________,_____________________________________。
-
(12分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
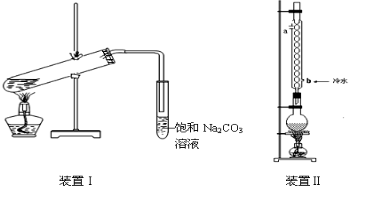
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 |  熔点/℃ 熔点/℃
| 沸点/℃ |
| 乙 醇 | -114 | 78 |
| 乙 酸 | 16.6 | 117.9 |
| 乙酸乙酯 | -83.6 | 77.5 |
| 98%H2SO4 | 10 | 338 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式 ,浓H2SO4的作用是 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振荡,静置, (填现象),然后将产物从__ __口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
-
已知下列数据:
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
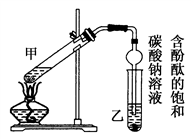
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。
















