-
某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
-
某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
-
某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
-
六氨氯化镁(MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主要成分MgCO3,含少量FeCO3等杂质)为原料制备氨氯化镁,实验流程图如下
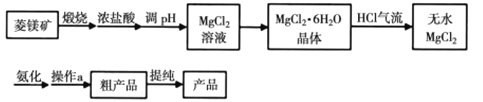
其中氨化过程装置示意图如下:
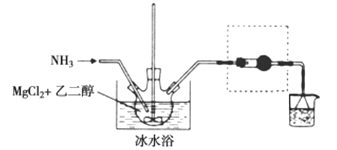
已知:①与Mg2+结合能力:H2O>NH3>HOCH2CH2OH>CH2OH②相关物质的性质见下表
| NH3的溶解性 | MgCl2的溶解性 | MgCl2·6NH3的溶解性 |
| 水 | 易溶 | 易溶 | 易溶 |
| 甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
| 乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
(1)调pH适合的物质是___________(填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是___________(用化学方程式表示)。
(3)虚框内装置的作用是___________,操作a的名称是___________。
(4)提纯操作中,下列洗涤剂最合适的是___________。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol· L-1 AgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、e操作2~3次,平均消耗AgNO3标准溶液10.00mL
①配制样品溶液时加硫酸的目的是___________。
②该样品中氯离子百分含量为___________。
③将氯离子百分含量实验值与理论值(36.04%)相比较,请分析造成此结果的可能原因有___________(已知滴定操作正确、硫酸根离子对检测无影响)
-
以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:

已知:
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。

(3)酸浸中Ni 和浓硝酸反应的化学方程式为___________。
(4)加人试剂X 为_____(填下列提供试剂的序号),可调节溶液pH 至______(填pH 范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)= 2.0mol/L,若要处理1L该滤液使Ni2+ 完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2 位有效数字)
-
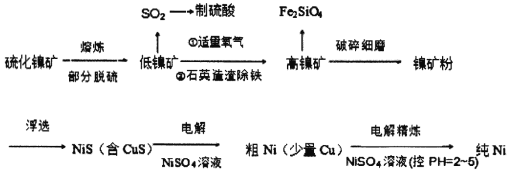
元素Ni用途广泛,工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
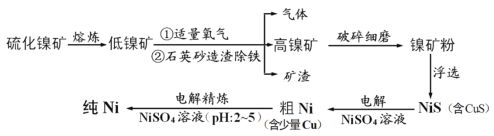
已知:①电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2 -2e-= 2H+ E=0.00V; Cu-2e- =Cu2+ E=0.34V;
Fe -2e-= Fe2+ E=-0.44V; Ni-2e-=Ni2+ E=-0.25V
②常温下溶度积常数 Ksp(NiS)=1.07×10-21; Ksp(CuS)=1.27×10-36
(1)可用光洁的镍丝代替铂丝蘸取化学试剂在焰色反应实验中灼烧,原因是_________。
(2)就制备高镍矿的相关问题请回答:
①通入氧气时控制适量的目的是________________。
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是__________________。
(3)电解制粗镍时阳极发生的主要电极反应式___________________。
(4)电解精炼镍的过程需控制pH为2~5,试分析原因__________________。
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+) 为0.107 mol/L,则滤液中残留的c(Cu2+)为________ mol/L。
-
元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
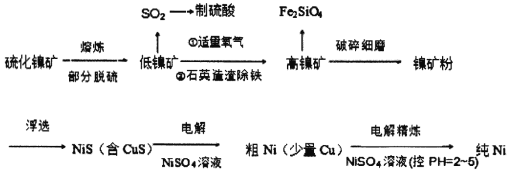
已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
-
元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
-
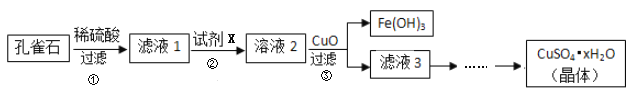
孔雀石的主要成分是 ,还含有少量
,还含有少量 、
、 等杂质,实验室以孔雀石为原料制备硫酸铜晶体流程如下:
等杂质,实验室以孔雀石为原料制备硫酸铜晶体流程如下:
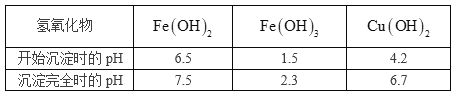
已知相关氢氧化物沉淀的pH范围如下:
完成下列填空:
(1)滤液1中含有的金属阳离子有_______________。
(2)步骤②中所用的试剂X是________(选填编号)。
a. Fe粉 b.  c. 氨水 d. KSCN
c. 氨水 d. KSCN
(3)步骤③中加入CuO的目的是________________________________________。
(4)由滤液3得到硫酸铜晶体,需要经过的步骤依次有:_________、________、过滤等。
(5)为测定所得晶体中结晶水的 值,可采用加热法。取
值,可采用加热法。取 g晶体灼烧至结晶水全部失去,称得无水硫酸铜的质量bg。
g晶体灼烧至结晶水全部失去,称得无水硫酸铜的质量bg。
①晶体应盛装在________(填仪器名称)中进行灼烧。
②确认结晶水已全部失去的方法是___________________________。
③ 值的表达式为______________(用
值的表达式为______________(用 、
、 表示)。
表示)。
④实验结果发现测得结晶水数量 偏高,可能的原因有___________(任写一种)。
偏高,可能的原因有___________(任写一种)。
-
某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:
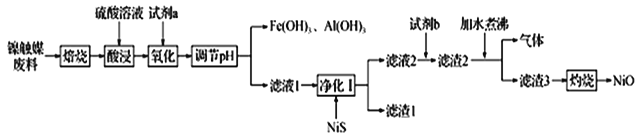
已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
| 物质 | Ksp | 物质 | Ksp |
| Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
| Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
| Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
| Ni(OH)2 | 2.0×10-15 | | |
表2 原料价格表
| 物质 | 价格/(元•吨-1) |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol •L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。












