-
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
________
(2)写出表征甲烷燃烧热的热化学方程式:
________
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
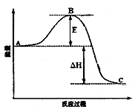
① 图中C表示E的大小对该反应的反应热有无影响?________。
② 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
-
已知25℃时:①H+(aq)+OH-(aq)=H2O(l) △H1=-57.3kJ/mol
②HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H2=-67.7kJ/mol
③Ba2+(aq)+SO42-(aq)=BaSO4(s) △H3<0
下列说法正确的是( )
A.△H1=-57.3kJ/mol是强酸和强碱在稀溶液中反应生成可溶性盐的中和热
B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大
C.HF的电离方程式及热效应:HF(aq) H+(aq)+F-(aq) △H>0
H+(aq)+F-(aq) △H>0
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为
H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H=-114.6kJ/mol
-
已知25℃时:①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH3<0
下列说法正确的是
A.HF的电离方程式及热效应:HF(aq)===H+(aq)+F-(aq) ΔH>0
B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大
C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+ 2H2O(l)ΔH=-114.6 kJ·mol-1
-
已知25℃时: ①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)=BaSO4(s)△H3<0
下列说法正确的是( )
A. HF的电离方程式及热效应:HF(aq)⇌H+(aq)+F-(aq)△H>0
B. 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大
C. △H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D. 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为 H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6kJ•mol-1
-
已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)ΔH1=-67.7kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l)ΔH2=-57.3kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH3<0
下列说法正确的是( )
A.HF的电离方程式及热效应:HF(aq) H+(aq)+F-(aq) ΔH>0
H+(aq)+F-(aq) ΔH>0
B.在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大
C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
-
已知H+(aq) +OH-(aq) === H2O(l) ΔH=-57.3 kJ·mol-1。以下四个化学方程式其中反应热为57.3 kJ·mol-1的是( )
①H2SO4(aq)+2NaOH(aq) === Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq) === BaSO4(s)+2H2O(l)
③HCl(aq)+NH3·H2O(aq) === NH4Cl(aq)+H2O(l)
④CH3COOH(aq)+ NH3·H2O(aq) === CH3COONH4(aq)+H2O(l)
A.①和② B.③ C.④ D.以上都不对
-
已知中和热的热化学方程式为H + (aq)+OH - (aq)=H2O(l)△H=-57.3kJ·mol-1。下列反应均在稀溶液中进行,其中△H=-57.3kJ·mol-1的是
A. NaOH(aq)+ HNO3 (aq)= NaNO3(aq) + H2O(l) △H
B. NH3·H2O(aq)+ HCl(aq)= NH4Cl(aq)+ H2O(l) △H
C. HF(aq)+ KOH(aq)= KF(aq)+ H2O(l) △H
D. ½H2SO4(aq)+ ½Ba(OH)2(aq)= ½BaSO4(s)+ H2O(l) △H
-
已知稀溶液中H+(aq)+OH-(aq)===H2O(l),生成1 mol H2O(l)放出57.3 kJ 热量。下列过程中放出热量为57.3 kJ的是
A. 1 mol H2SO4与足量的NaOH溶液反应
B. 稀盐酸与氨水反应生成1 mol H2O(l)
C. 稀盐酸与稀Ba(OH)2溶液反应生成1 mol H2O(l)
D. 稀NaOH与98%浓硫酸反应生成 1 mol H2O(l)
-
已知稀溶液中H+(aq)+OH-(aq)=H2O(l),生成1 mol H2O(l)放出57.3 kJ热量。下列过程中放出热量为57.3 kJ的是( )
A. 1 mol H2SO4与足量的NaOH溶液反应
B. 稀盐酸与氨水反应生成1 mol H2O(l)
C. 稀盐酸与稀Ba(OH)2溶液反应生成1 mol H2O(l)
D. 稀NaOH与98%浓硫酸反应生成1 mol H2O(l)
-
下列各项中正确的是( )
A. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1
B. 已知CH3OH(g)+1/2O2(g) == CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1 ,则2H2O(g) == 2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g) == 3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
