-
Ⅰ.甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51 kJ,则表示甲醇燃烧的热化学方程式为_______________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1 ②CH3OH(g)+  O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+  O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
(3)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。
CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。
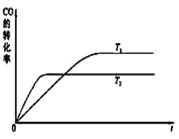
①该反应的焓变ΔH______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
(4)H2 和CO合成甲醇反应为:CO(g)+2H2(g) CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
(5) 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H 。
CH3OH(g) +H2O(g) △H 。
①该反应的平衡常数表达式为K=___________。
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3)发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则△H _________0(填“大于”或“小于”)
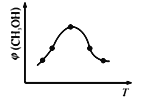
-
(12分)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ,则甲醇燃烧的热化学方程式为 。
(2)甲醇燃料电池的结构示意图如下左图。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
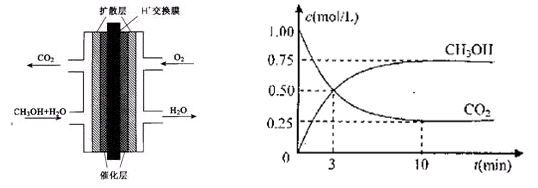
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H =-49.0KJ/mol
CH3OH(g)+H2O(g) △H =-49.0KJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=________
②该反应的平衡常数表达式为。
③下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
-
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是( )。
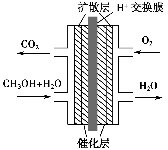
A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
-
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是 ( )。

A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
-
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知:



1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为________。
和水蒸气的热化学方程式为________。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是________(双选)。
CH3OH(g)反应速率的是________(双选)。
A.分离出CH3OH B.升高温度 C.减小压强 D.加入合适的催化剂
(3)(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):
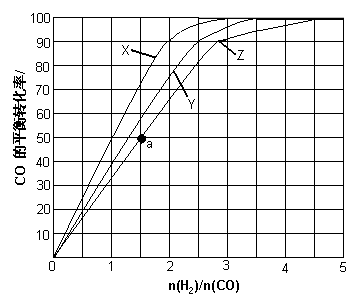
①曲线X对应的温度是________。
②从图中可以得出的结论有________(任写一条)。
(4)若往反应的容积中加入1.5molH2 和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g) CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)
-
已知25℃、101kPa时,1g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时发出22.68kJ热量。则下列表示该反应的热化学方程式正确的是
A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H=-725.8kJ•mol-1
B.2 CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ
C.2 CH3OH+3O2=2CO2+4H2O △H=-22.68kJ•mol-1
D.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ•mol-1
-
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g)═CO2(g)+2H2O(l)△H=+725.8kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=+725.8kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452kJ/mol
-
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8 kJ·mol-1
B.2 CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) △H=+1451.6 kJ·mol-1
C.2 CH3OH+O2 = 2CO2+4H2O △H=-22.68 kJ·mol-1
D.CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8 kJ·mol-1
-
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8 kJ·mol-1
B.2 CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) △H=+1451.6 kJ·mol-1
C.2 CH3OH+O2 = 2CO2+4H2O △H=-22.68 kJ·mol-1
D.CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8 kJ·mol-1
-
甲醇即是重要的化工原料,又是新型汽车动力燃料。已知甲醇常温下为液态,其燃烧△H=-726.5KJ/mol。
(1)写出表示甲醇燃烧热的热化学方程式: 。
(2)甲醇脱氢制取甲醛的原理为CH3OH(g)  HCHO(g)+H2(g),某科研小组在1L密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示,回答下列问题:
HCHO(g)+H2(g),某科研小组在1L密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示,回答下列问题:

①由图可知,该反应的△H 0(填“>”、“<”、“=”)。
②下列选项中,能说明该反应达到平衡状态的是 。
A.v(CH3OH)=v(HCHO)
B.H2浓度不再变化
C.混合气体平均相对分子质量不再变化
D.混合气体密度不变
③在t1K时,该反应的平衡常数为K ,此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)为 mol/(L·s),向此容器中再通入1.1molCH3OH和1.1molH2,则平衡向 移动(填“向左”、“向右”、“不”)
④600K时,Y点甲醇的v(正) v(逆) (填“>”、“<”、“=”),理由是 。
(3)某甲醇燃料电池(简称DMFC),该电池由于结构简单,能量转化率高,对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:

①负极的电极反应式为 。
②若质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液,当电池中有1mol电子转移时,左右两侧溶液的质量之差为 g(忽略气体的溶解,假设反应完全耗尽)
O2(g)= CO2(g)+2H2(g) △H2
O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。

CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
CH3OH(g) +H2O(g) △H 。






