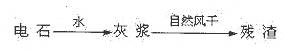-
KClO3在农业上用作除草剂,超细CaCO3广泛用于消光纸、无炭复写纸等.某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
(1)写出电石与水反应的化学方程式是____________________________;
Ⅱ.将Ⅰ中的部分灰浆配成浊液,通入Cl2得到Ca(ClO3)2与CaCl2的混合溶液,向所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体.
(2)你认为能得到KClO3晶体的原因是____________________________;
Ⅲ.将Ⅰ中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用.向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下.
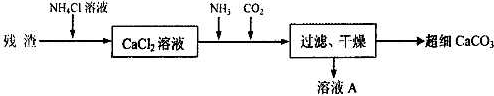
(3)根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因_____________________,此过程可循环利用的物质是_____________;
Ⅳ.Ⅲ中收集挥发出的气体之一CO2与C反应生成CO,再利用一氧化碳与氢气反应生成甲醇,一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)⇌CH3OH(g)△H
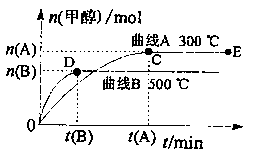
(4)根据题意完成下列各题:
①CO(g)+2H2(g)⇌CH3OH(g)的△H________小于0(填“大于”、“小于”或“等于”);
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________;
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是______
,下列有关该体系的说法正确的是______
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2):n(CH3OH)增大
-
(12 分)
KClO3在农业上用作除草剂,超细CaCO3泛用于消光纸、无炭复写纸等。某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.
①电石与水反应的化学方程式是__________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
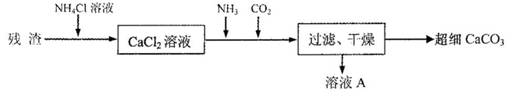
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________
-
(14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:
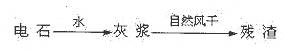
I.残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是________。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2________升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
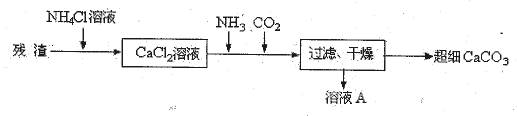
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________。
-
硫酸亚铁是比较重要的亚铁盐,在农业上用作农药,主治小麦黑穗病,在工业上用于染色、制造蓝黑墨水和木材防腐、除草剂等.
(1)实验室条件下用铁粉和稀硫酸制取少量硫酸亚铁溶液,为防止其变质,应在该溶液中应加入适量______.
(2)新制的绿矾晶体是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______.
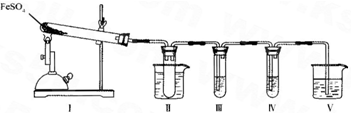
(3)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8°C,沸点是44.8°C.
①装置II的试管中不装任何试剂,其作用是______,试管浸泡在50℃的热水浴中,目的是______.
②装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol.L-1.H2S04、6mol.L-l NaOH、0.5mol.L -1 BaCl2、O.5mol.L-1Ba(NO3)2、0.01mol.L-1 酸性 KMnO4 溶液、0.0l mol.L-1 溴水.
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______
______. |
③装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是______.
④如何检验装置Ⅰ中固体完全分解后生成固体产物有无FeO?写出步骤、现象及结论:______.
-
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、A12O3、 SiO2等)制备铬黄的工艺流程如下:
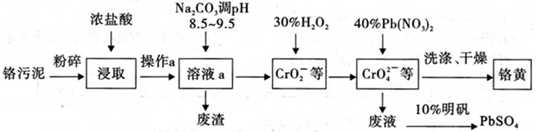
(1)将铬污泥粉碎的目的是________,操作a的名称为________;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为________(保留两位有效数字);
Al(OH)3+3H+的平衡常数为________(保留两位有效数字);
(3)写出加入30%H2O2过程中发生的离子反应方程式:________;
(4)实验室洗涤铬黄沉淀的方法:;
(5)写出浓盐酸与A12O3反应的离子方程式:________。
-
(12分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
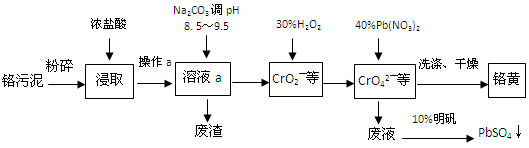
(1)将铬污泥粉碎的目的是________。操作a的名称为________。
(2)废渣的主要成分是Al(OH)3和Fe(OH)3。已知25℃时,Al(OH)3的Ksp=1.3×10—33,则该温度下反应Al3+ + 3H2O  Al(OH)3 +3H+的平衡常数为________。
Al(OH)3 +3H+的平衡常数为________。
(3)写出加入30%H2O2过程中发生的离子反应方程式:________。
(4)加入Pb(NO3)2沉淀CrO42—时,检验沉淀是否完全的方法是________。
(5)在废液中加入10%明矾溶液发生反应的化学方程式为________。
-
铬酸铅(PbCrO4)俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
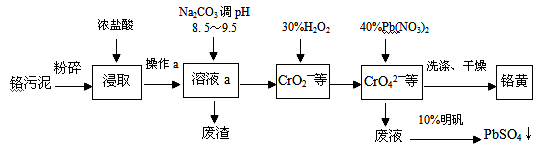
(1)铬黄中,铬的化合价为 价
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 ,操作a的名称为
(3)写出加入30%H2O2过程中发生的离子反应方程式
(4)在废液中加入10%明矾溶液发生反应的离子方程式为
(5)对含铬废水进行处理的方法是:将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①写出Fe2+和Cr2O72-发生反应的离子方程式
请分析电解过程中溶液pH不断上升的原因
-
(13分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
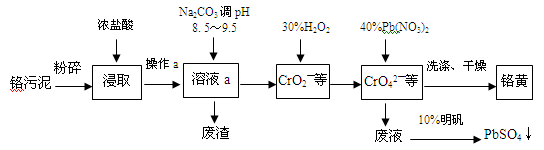
(1)操作a的名称为 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72
 -发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因 。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为 mol。
-
铬酸铅俗称铬黄,不溶于水.广泛用于涂料、油墨、漆布、塑料和文教用品等工业.实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
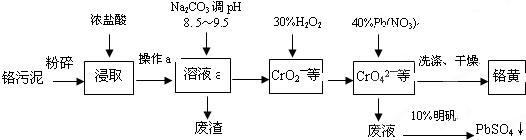
(1)将铬污泥粉碎的目的是______.操作a的名称为______.
(2)废渣的主要成分是Al(OH)3和Fe(OH)3.已知25℃时,Al(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为______.
Al(OH)3+3H+的平衡常数为______.
(3)写出加入30%H2O2过程中发生的离子反应方程式:______.
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是______.
(5)在废液中加入10%明矾溶液发生反应的化学方程式为______.
-
纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业。某化学兴趣小组在实验室中利用下列装置模拟工业制备纳米CaCO3.
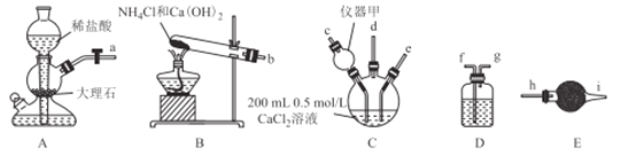
请回答下列问题:
(1)仪器甲的名称是________,在该实验中,其作用是_____.
(2)将上述接口连接顺序补充完整:a ;b
;b ;d
;d 。__________
。__________
(3)装置D中选择的试剂是__________(填序号,下同),装置E中选择的试剂是__________
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为__________
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为_______(结合化学用语解释)。
(6)当生成5g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为_________
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0mol/L的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中c(SO32-)/c(CO32-)的值(x)的取值范围为__________。



,下列有关该体系的说法正确的是______