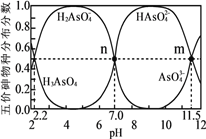-
H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。下列有关说法不正确的是( )
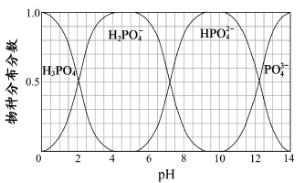
A.在pH=13时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(PO43-)
B.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5 左右
C.在pH=7.2时,HPO42-、H2PO4-的分布分数各为0.5,则H3PO4的Ka2=10-7.2
D.Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性
-
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是

A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8
B.Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性
C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右
D. pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+)
-
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是
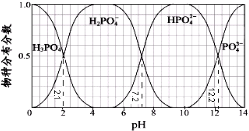
A.H3PO4的Ka3=10–12.2,HPO42–的水解平衡常数为10–6.8
B.Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性
C.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42–)>c(PO43-)>c(OH-)>c(H+)
D.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右
-
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是
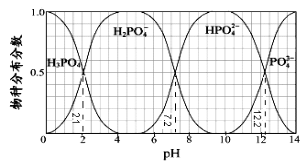
A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8
B.Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性
C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右
D.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+)
-
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得。室温下,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
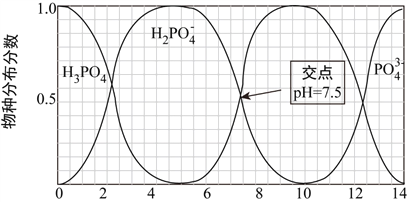
下列说法中正确的是( )
A. 电离方程式:H3PO4=3H++PO43-
B. pH=7时存在c(Na+)=c(H2PO4-)+c(HPO42-)
C. 向Na3PO4溶液中加入NaH2PO4溶液,不会发生化学反应
D. 相同温度和浓度下,H2PO4-的电离能力弱于HPO42-的水解能力
-
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得。室温下,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
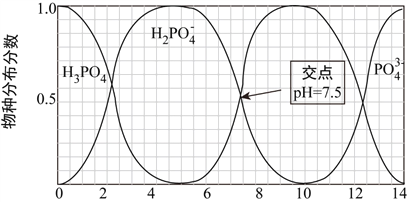
下列说法中正确的是( )
A. 电离方程式:H3PO4=3H++PO43-
B. pH=7时存在c(Na+)=c(H2PO4-)+c(HPO42-)
C. 向Na3PO4溶液中加入NaH2PO4溶液,不会发生化学反应
D. 相同温度和浓度下,H2PO4-的电离能力弱于HPO42-的水解能力
-
砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
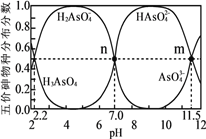
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
-
常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+ H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
-
常温下,往 H3PO4 溶液中滴加 NaOH 溶液,体系中含磷各物种所占的物质的量分数 (α)随溶液pH 变化的关系如图所示。下列有关说法不正确的是

A.为尽可能得到较纯的 NaH2PO4,pH 应控制在 4~5.5 左右
B.在 pH<7.2 的溶液中,c (H2PO4 - )>c (HPO42 -)
C.当 pH=7.2 时,H2PO4 - 与 HPO42 -的物质的量相等且等于原溶液磷酸物质的量的一半
D.pH=13 时,溶液中各微粒浓度大小关系为:c (Na+)>c (PO43-)>c (HPO42-)>c (OH-)>c (H+)
-
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是
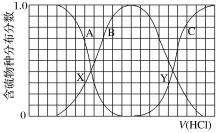
A. X、Y为曲线两交叉点。由X点处的pH,可计Ka1(H2S)
B. Y点对应溶液中c(Na+)与含硫各微粒浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C. X、Y点对应溶液中水的电离程度大小关系为:X > Y
D. 已知NaHS呈碱性,若向溶液中加入CuSO4溶液至恰好完全反应,所得溶液呈强酸性。其原因是Cu2++HS-=CuS↓+H+