-
氮和碳的化合物在生产生活中应用广泛。
(1)①氯胺(NH2Cl)的电子式为______。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=_________。
| 化学键 | N﹣H | Cl﹣Cl | N﹣Cl | H﹣Cl |
| 键能/(kJ·mol﹣1) | 391.3 | 243.0 | 191.2 | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为_______________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为_________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=__________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
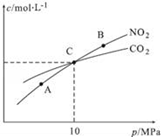
①A、B两点的浓度平衡常数关系:Kc(A)___Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是__(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:
CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:
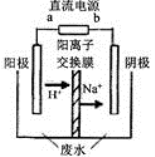
①试写出电解过程中,阴极的电极反应式:______________________ 。
②在实际处理过程中,当电路中I=50A时,10min处理乙醛8.8g,则电流效率为______(计算结果保留3位有效数字,每个电子的电量为1.6×10-19C,电流效率=实际反应所需电量/电路中通过电量×100%)。
-
氮和碳的化合物在生产生活中应用广泛。
(1)①氯胺(NH2Cl)的电子式为_______________。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为__________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为_______________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=___________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
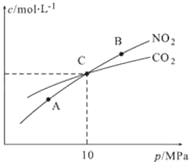
①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是__________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
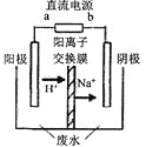
①试写出电解过程中,阴极的电极反应式:_________________________。
②在实际处理过程中,当电路中I=50A时,10min处理乙醛8.8g,则电流效率为__(计算结果保留3位有效数字,每个电子的电量为1.6×10-19C,电流效率=实际反应所需电量/电路中通过电量×100%)。
-
氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的∆H=__________kJ·mol—1
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g)  2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g)  2NH3(g) ∆H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) ∆H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
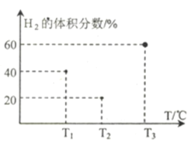
①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
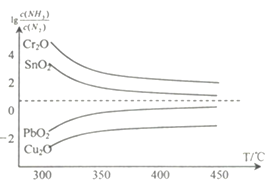
A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量
-
氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的∆H=__________kJ·mol—1
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g)  2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g)  2NH3(g) ∆H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) ∆H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
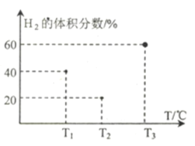
①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
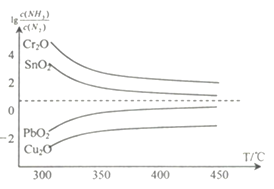
A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量
-
氮的化合物在生产生活中广泛存在。
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
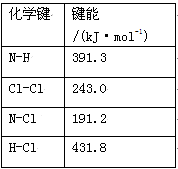
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
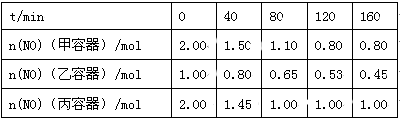
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
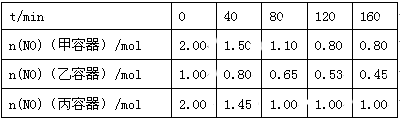
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
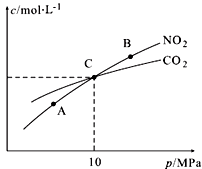
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
氮的化合物在生产生活中广泛存在。
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
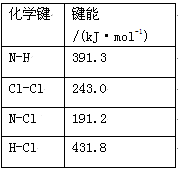
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
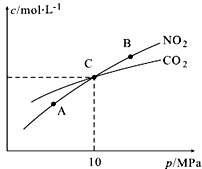
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
氮的化合物在生产生活中广泛存在。
(1)氯胺(NH2Cl)的电子式为___。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=___。
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/(kJ·mol-1) | 391 | 243 | 191 | 431 |
(2)液氨中存在电离平衡2NH3(l) NH
NH +NH
+NH ,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
(3)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
| t/min | 0 | 20 | 40 | 60 | 80 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为___(填“放热”或“吸热”)反应,理由是___;
②下列选项中可以说明容器乙已经达到平衡状态的是___(填序号)
A.容器内压强不变
B.容器内气体的密度不变
C.2υ正(NO)=υ逆(N2)
D.混合气体的平均摩尔质量不变
③乙容器在100min达到平衡状态,则0~100min内用NO的浓度变化表示的平均反应速率υ(NO)=___,平衡常数K(400℃)=___。
-
氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
| 化学键 | 键能/(kJ·mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
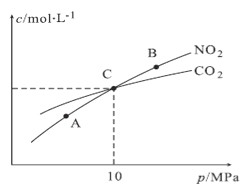
①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
| 化学键 | 键能/(kJ·mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
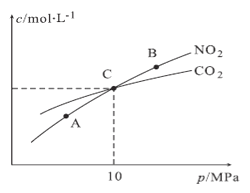
①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
| 化学键 | 键能/(kJ·mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
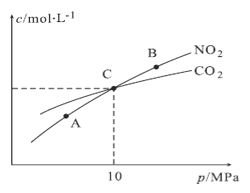
①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:















