-
CO2的大量排放不仅会造成温室效应还会引起海水中富含二氧化碳后酸度增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。所以二氧化碳的吸收和利用成为当前研究的重要课题。
(1)工业上以CO2与H2为原料合成甲醇,再以甲醇为原料来合成甲醚。
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2=-24.5 kJ•mol﹣1
2CO2(g)+6H2(g)⇌ CH3OCH3(g)+3H2O(g) △H3=-122.5 kJ•mol﹣1
甲醇的电子式为________________;△H1=________kJ·mol-1
(2)某科研小组探究用活性炭处理汽车尾气的可行性,在T1℃体积为2L的恒温密闭容器中进行了实验,并根据实验数据绘制了如下图像,其中X代表NO浓度变化,Y代表N2和CO2浓度变化:
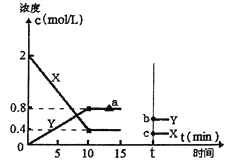
①若15min,后升高到一定温度,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,到达到新平衡时CO2的反应速率与图中a点相比较,速率_____(填“增大”、“减小”或“不变”),此时平衡常数K与T1℃相比_______(填“增大”、“减小”或“不变”)。②T1℃时该反应的平衡常数为_________________。
③如上图所示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。则改变的条件可能是_______(填序号)。
a.扩大容器体积 b.升高温度 c.使用合适催化剂 d.移走部分NO
(3)已知:H2CO3的电离常数Ka1=4.4×10-7,Ka2=5×10-11。25℃时若用1L 1mol· L-1的NaOH溶液吸收CO2,当溶液中c(CO32-):c(H2CO3)=2200,此时该溶液的pH值为________________。
(4)以熔融K2CO3为电解质的甲醚燃料电池,具有能量转化率高,储电量大等特点,则该电池的负极电极反应式为______________________。
-
化学与生活、环境、科技等密切相关。下列说法不正确的是( )
A.温室效应导致海水的酸度增加,贝壳类生物的生存将会受到威胁
B.具有吸水性的植物纤维加工后可用作食品干燥剂
C.石墨烯弹性气凝胶制成的轻质“碳海绵”可用作处理海上原油泄漏的吸油材料
D.油脂的主要成分是高级脂肪酸甘油酯,长时间放置的油脂会因水解而变质
-
化学与生活、环境、科技等密切相关。下列说法不正确的是
A. 温室效应导致海水的酸度增加,贝壳类生物的生存将会受到威胁
B. 油脂的主要成分是高级脂肪酸甘油酯,长时间放置的油脂会因水解而变质
C. 石墨烯弹性气凝胶制成的轻质“碳海绵”可用作处理海上原油泄漏的吸油材料
D. 具有吸水性的植物纤维加工后可用作食品干燥剂
-
化学与生产和生活密切相关,下列说法不正确的是
A.温室效应导致海水的酸度增加,珊瑚、贝壳类等生物的生存将会受到威胁
B.焰火的五彩缤纷是某些金属元素的性质的展现
C.对“地沟油”进行分馏可得到汽油
D.将煤气化后再作为能源,可以减少PM2.5引起的危害
-
化学与能源、环境、生产、生活密切相关。下列说法不正确的是( )
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.可利用工业生产产生的二氧化碳制造全降解塑料
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
-
化学与能源、环境、生产、生活密切相关。下列说法不正确的是
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.可利用工业生产产生的二氧化碳制造全降解塑料
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
-
引起下列环境污染的原因不正确的是
A.重金属、农药和难分解有饥物等会造成水体污染
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C. 、
、 或
或 都会导致酸雨的形成
都会导致酸雨的形成
D. 和氟氯烃等物质的大量排放会造成温室效应的加剧
和氟氯烃等物质的大量排放会造成温室效应的加剧
-
下列叙述正确的是( )
①CO2的大量排放会加剧温室效应
②正常雨水的pH为5.6,主要是因为溶解了SO2
③利用太阳能、风能和氢能替代化石能源可以改善空气的质量
④含磷合成洗涤剂易于被细菌分解,不会导致水体污染
⑤为防止电池中的重金属离子污染土壤和水源,废电池要集中处理
A.①②③④⑤ B.②③⑤ C.①③⑤ D.①②④⑤
-
化学与能源、环境、生产、生活密切相关。下列说法不正确的是( )。
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.淀粉、油脂、蛋白质都能水解但水解产物不同
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但无净水作用
-
化学与能源、环境、生产、生活密切相关.下列说法不正确的是( )
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.淀粉、油脂、蛋白质都能水解但水解产物不同
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但无净水作用
