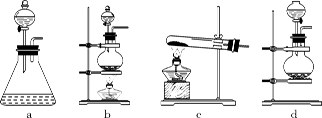-
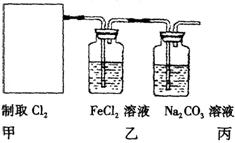
某学习小组同学以二氧化锰和浓盐酸为原料,连接A→B→C制取氯水。

(1)装置A中发生反应的离子方程式是 。
(2)B中得到的饱和氯水是浅黄绿色,将所得氯水分为三等份,进行实验操作及现象如下:
| 实验序号 | 实验操作 | 现象 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
| Ⅱ | 向氯水中滴入品红溶液 | 品红溶液褪色 |
①甲同学通过实验Ⅰ得出结论:氯气与水反应至少产生一种酸性强于碳酸的物质。乙同学指出甲同学的结论不合理,原因是制取的氯气中含有杂质 (填化学式),也能与碳酸氢钠反应产生气泡。请你完善右图所示除杂的仪器装置图,并标出药品名称。

②丙同学通过实验Ⅱ得出结论:氯气与水反应的产物有漂白性。丁同学指出丙同学结论不合理,原因是此实验未证明 (填化学式)是否有漂白性。
③戊同学依据上述现象和元素守恒推测产物中应该有盐酸,请你设计实验检验Cl-的存在: 。
④庚同学利用正确的实验装置和操作进行实验,观察到实验现象与实验Ⅰ、Ⅱ中相似,氯水具有的性质是 。
(3)将第三份氯水分成两等份,向其中一份中加入等体积的蒸馏水,溶液接近无色。另一份中加入等体积饱和的氯化钠溶液,溶液变为浅黄绿色;请用平衡原理简述溶液变为浅黄绿色原因是 。
-
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示: 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是 (填字母);指出a中m仪器的名称 。


②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填加试剂的名称、至少填二种)方法 、
;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入 溶液:
溶液: ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
-
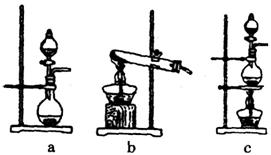
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有______;
(2)①装置B中盛有的试剂是______,作用是______.
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是______.证明FeBr2与Cl2发生了氧化还原反应的实验方法是______(填操作方法).
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为______.
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是______;判断的原因是______.
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴______ (填序号).若溶液______(填现象),则假设1成立.
步骤三:向B试管中滴加1~2滴______(填序号);若溶液______(填现象),则假设2成立.
③若假设2成立;写出步骤三中的离子方程式:______.
-
实验小组以二氧化锰和浓盐酸为反应物,连接装置A→B→C制取氯水,并探究氯气和水反应的产物。
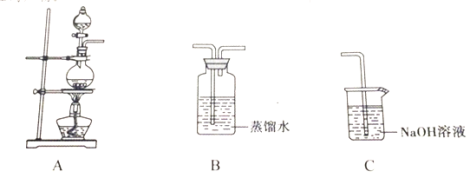
(1)A中发生反应的离子方程式是_________。
(2)B中得到浅黄绿色的饱和氯水,将所得氯水分三等份,进行的操作、现象、结论如下:
| 实验 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
| Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
(1)甲同学指出:由实验Ⅰ得出的结论不合理,原因是制取的氯水中含有杂质______(填化学式),也能与碳酸氢钠反应产生气泡。应在A、B间连接除杂装置,请画出除杂装置并标出气体流向和药品名称______。
(2)乙同学指出由实验Ⅱ得出的结论不合理,原因是实验未证明_______(填化学式)是否有漂白性。
(3)丙同学利用正确的实验装置发现氯水中有Cl-存在,证明氯水中有Cl-的操作和现象是:_____。丙同学认为,依据上述现象和守恒规律,能推测出氯水中有次氯酸存在。这一推测是否正确,请说明理由________。
(4)丁同学利用正确的实验装置和操作进行实验,观察到实验现象与实验Ⅰ、Ⅱ相似,说明氯气和水反应的产物具有的性质是________。
(5)戊同学将第三份氯水分成两等份,向其中一份加入等体积的蒸馏水,溶液接近无色。另一份中加入等体积饱和的氯化钠溶液,溶液为浅黄绿色。对比这两个实验现象能说明:_______。
-
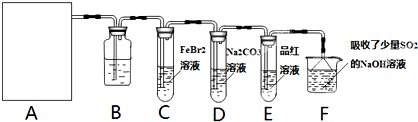
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
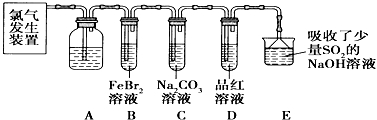
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有 、 .
(2)装置A中盛有的试剂是: ,作用是: .
(3)若D中品红溶液褪色,则B装置发生反应的离子方程式是: .
(4)证明FeBr2与Cl2发生了(3)中氧化还原反应的实验方法是: (填操作方法).
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl﹣、OH﹣、CO32﹣和SO42﹣,对于可能存在的其他阴离子,研究小组提出以下3种假设:
假设1:只存在SO32﹣; 假设2:只存在ClO﹣; 假设3:既不存在SO32﹣,也不存在ClO﹣.
(5)学习小组判断同时存在SO32﹣和ClO﹣是不可能的,理由是: .
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol•L﹣1 H2SO4 b.0.01mol•L﹣1 KMnO4 c.1mol•L﹣1 BaCl2溶液 d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3mol•L﹣1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量 (填序号),若溶液 (填现象),则假设1成立.
步骤三:向B试管中滴加少量 (填序号),若溶液 (填现象),则假设2成立.
-
氯气是一种重要的化工原料。某学习小组在实验室中利用如图所示装置制取氯气并探究其性质。
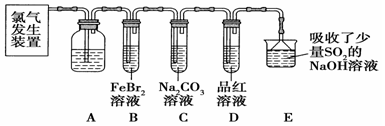
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有 、 。
(2)装置A中盛有的试剂是: ,作用是:________________________。
(3)若D中品红溶液褪色,则B装置发生反应的离子方程式是: 。
(4)证明FeBr2与Cl2发生了(3)中氧化还原反应的实验方法是: (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO32-,对于可能存在的其他阴离子,研究小组提出以下3种假设:
假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的,理由是: 。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a. 3 mol·L-1 H2SO4 b.0.01 mol·L-1 KMnO4 c.1 mol·L-1 BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量 (填序号),若溶液__________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量 (填序号),若溶液__________________(填现象),则假设2成立。
-
氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是________。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O他们利用该反应设计如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们利用该反应设计如下制取氯气并验证其性质的实验。
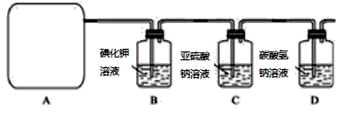
回答下列问题:(1)该实验中A部分的装置是_______(填标号)。
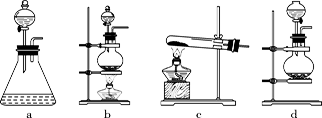
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_____________________________。
(3)写出D装置中发生反应的离子方程式_________________
(4)该实验存在明显的缺陷,请你提出改进的方法__________________________________________写出反应离子方程式_____________________________________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol.L−1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2===Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为________。
-
(12分)氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是________。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4  2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。

(1)回答下列问题:(1)该实验中A部分的装置是________ (填标号) 。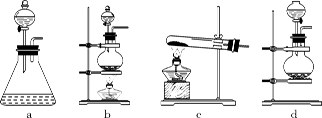
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):________。
(3)写出D装置中发生反应的离子方程式________(4)该实验存在明显的缺陷,请你提出改进的方法________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L?1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为________。
-
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
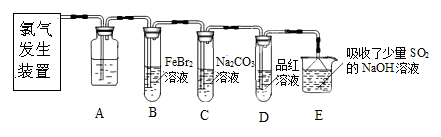
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
________;
(2)装置A中盛有的试剂是________,作用是。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是________(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是________。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
-
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
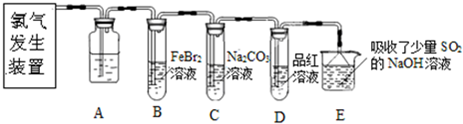
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有________;
(2)装置A中盛有的试剂是________,作用是________.
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是________(填操作方法).
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是________.
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量________ (填序号),若溶液________(填现象),则假设1成立.
步骤三:向B试管中滴加少量________(填序号),若溶液________(填现象),则假设2成立.