-
氨在工农业生产中应用广泛。德国人哈伯发明了合成氨反应,其原理为:N2(g) + 3H2(g)  2NH3(g) ΔH=-92.4kJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
2NH3(g) ΔH=-92.4kJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
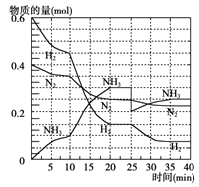
(1)10 min内用NH3表示该反应的平均速率,v(NH3)= 。
(2)在10~20min内NH3浓度变化的原因可能是 (填字母)。
A.加了催化剂 b.降低温度 C.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是__________ (填字母)。
a.3v(H2)正 = 2v(NH3)逆 b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化 d. N2、H2、NH3的分子数之比为1∶3∶2
e.单位时间生成m mol N2的同时消耗3 m mol H2 f.a mol N≡N键断裂的同时,有6 a mol N—H键合成
(4)第一次平衡时,平衡常数K1= (用数学表达式表示)。NH3的体积分数是 (保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是________________。
(6)已知:N2(g)+3H2(g)  2NH3(g) ΔH =-92.4 kJ/mol; 2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol,氨气与氧气反应产生氮气和水的热化学方程式是_______________。
2NH3(g) ΔH =-92.4 kJ/mol; 2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol,氨气与氧气反应产生氮气和水的热化学方程式是_______________。
(7)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如右图所示:
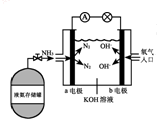
① a电极的电极反应式是______________;
② 一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_______________。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g)
2NH3(g)  。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间
。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间 的变化如下图所示:
的变化如下图所示:
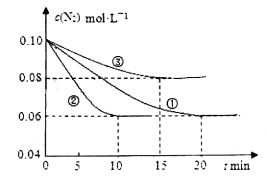
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L ,则该反应的平衡常数K=_______________;
,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
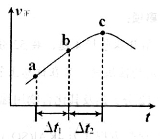
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C. 时,NO2的转化率:a~b段小于 b~c段
时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L 的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3
的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数
H2O的电离平衡常数 =___________。
=___________。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
在l L密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的___________、_________(填字母编号)。
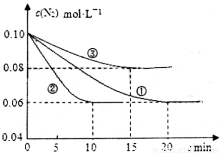
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_____________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
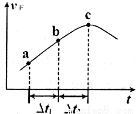
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将a mol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a__b。(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
(14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
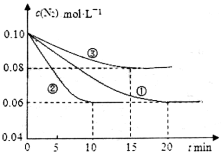
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
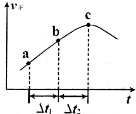
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g)  2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。

(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
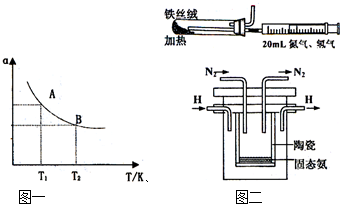
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
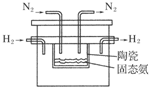
则阴极的电极反应式为____________________________________________________。
-
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
-
1992年德国化学家哈伯研究出合成氨的方法,基反应原理为:N2(g)+3H2(g)⇌2NH3(g);△H(△H<0)
(1)在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生反应,反应中NH3的物质的量浓度变化情况如图1:
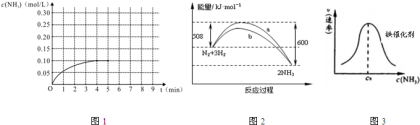
①根据图1,计算从反应开始到平衡时,平均反应速率v(H2)为________mol/(L•min);
②反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________________;
A. 0.20mol/L B. 0.12mol/L C. 0.10mol/L D. 0.08mol/L
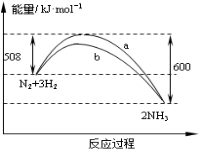
(2)某温度时,N2与H2反应过程中的能量变化如图2所示.下列叙述正确的是__________
A.b曲线是加入催化剂时的能量变化曲线
B.在密闭容器中加入1mol N2、3mol H2,充分反应放出的热量小于92kJ
C.由图可知,断开1mol 氮氮三键与1mol 氢氢键吸收的能量和小于形成1mol 氮氢键所放出的能量
D.反应物的总能量低于生成物的能量
(3)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.若用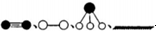 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
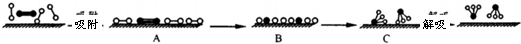
①吸附后,能量状态最低的是________(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是________________;c0后速率降低的原因可能是_______________;
(4)已知液氨中存在:2NH3(l)⇌NH2-+NH4+.用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是_______________;
-
1902年德国化学家哈伯研究出合成氨的方法,其反应原理为:
N2(g)+3H2(g) 2NH3(g); △H(△H<0)
2NH3(g); △H(△H<0)
(1)在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生反应,反应中NH3的物质的量浓度变化情况如右图:
①根据右图,计算从反应开始到平衡时,平均反应速率v(H2)为________mol/(L·min)。

②反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___________。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(2)某温度时,N2与H2反应过程中的能量变化如图所示。 下列叙述正确的是
A.b曲线是加入催化剂时的能量变化曲线
B.在密闭容器中加入1 mol N2、3 mol H2,充分反应放出的热量小于92 kJ
C.由图可知,断开1mol 氮氮三键与1 mol 氢氢键吸收的能量和小于形成1mol 氮氢键所放出的能量
D.反应物的总能量低于生成物的能量
(3)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用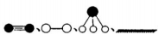 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。

(4)已知液氨中存在:2NH3(l)  NH2- + NH4+。用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
NH2- + NH4+。用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
-
德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)⇌2NH3(g) 已知298K时:△H=-92.4kJ•mol-1试回答下列问题:
(1)在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ?________.
(2)如图一在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答:
①N2的转化率αA为________.
②在状态A时,平衡常数KA=________(代入数值的表达式,不写出具体数值)当温度由T1变化到T2时,KA________KB(填“>”、“<”或“=”)
(3)图二是实验室模拟工业法合成氨的简易装置.简述检验有氨气生成的方法________.在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.阴极的电极反应式________.
-
德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1
2NH3(g) △H=-92.4kJ•mol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g) CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。
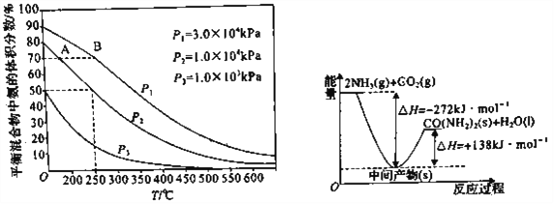
(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
2NH3(g) ΔH=-92.4kJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

2NH3(g) ΔH =-92.4 kJ/mol; 2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol,氨气与氧气反应产生氮气和水的热化学方程式是_______________。




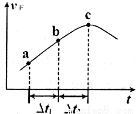

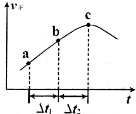


 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: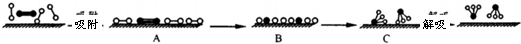


 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:


