-
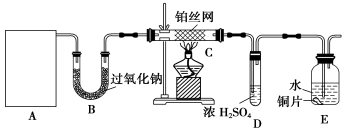
氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。
Ⅰ.实验室模拟工业氨催化氧化法制取硝酸,装置如下图所示。
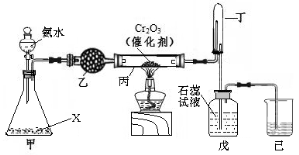
(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有烧杯、玻璃棒、量筒、 、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的化学式为 。
(3)写出受热时丙装置发生反应的化学方程式 。当戊中观察到石蕊试液变红,则说明已制得硝酸。
Ⅱ.NH3的性质
(4)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),将等浓度、等体积的氨水和硝酸混合,所得溶液中离子浓度从大到小的顺序为 。
(5)已知:氨在纯氧中燃烧生成一种单质和水,利用此原理设计成氨气-氧气燃料电池。在碱性条件下,该电池的负极反应式为 。
-
氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
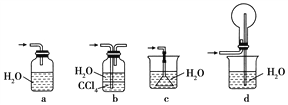
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
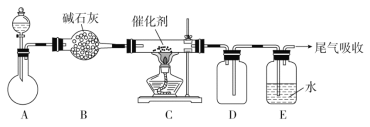
①检查装置气密性的方法是__________________________,D的作用是________。
A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________(填化学式)。
②反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是____________,试设计实验证明这种离子的存在:__________________________________________。
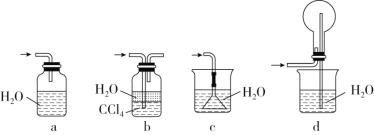
③下列哪个装置可以同时起到装置D和E的作用________(填代号)。
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________________,该反应生成的还原产物的化学键类型是________。
-
氨气是一种重要化合物,在工农业生产、生活中有着重要作用。
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
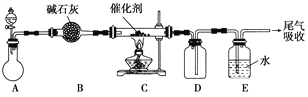
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________。
②C装置中发生反应的化学方程式为________________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是________,试设计实验证明这种离子的存在_____________________。
④下列哪些装置可以同时起到装置D和E的作用________(填代号)。
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________(不必配平),该反应生成的还原产物的化学键类型是________。
-
(12分)氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。完成下列填空:
实验室设计了如图所示的实验装置,进行“氨的催化氧化”等实验。
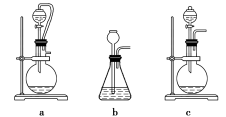
(1)A处是气体发生装置,A中所用试剂只能从下列物质中选取:
①硝酸铵 ②碳酸氢铵 ③氯化铵 ④熟石灰 ⑤氢氧化钠
若A中制取气体时只用了一种试剂,该试剂可以是____________(选填上述编号),此时A处的装置应为______________(选填下列编号)。
至此,完成了对图1中装置的补充。某同学从安全与环保的角度考虑,该装置存在两处明显的缺陷,你认为这两处缺陷是______________ 、_________________。
(2)写出图1装置B中发生反应的化学方程式(写一个即可) ;
在图1中,若A、B处试剂足量,则装置E中发生反应的离子方程式为:____________________。
(3)写出图1装置C中发生反应的化学方程式________________。
-
碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g)  2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g)  HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)  OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
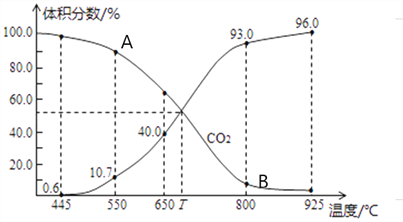
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
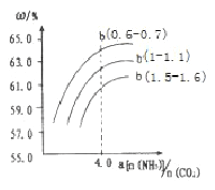
①b应控制在______
a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是_________
-
碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g)  2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g)  HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)  OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。

a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
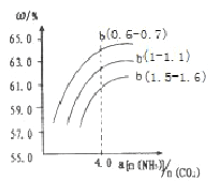
①b应控制在______
a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是_________
-
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
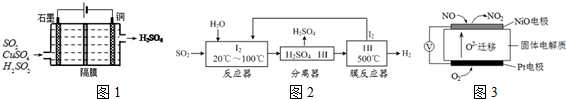
(1)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2﹣2n)H2O═2n CuSO4+(2﹣2n) H2SO4从环境保护的角度看,催化脱硫的意义为 ;每吸收2molSO2,被SO2还原的O2的质量为 g.
②利用如图1所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式 .
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图2:
①用离子方程式表示反应器中发生的反应是:
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
Ⅱ.汽车尾气是造成雾霾天气的重要原因之一.
已知氮的氧化物是汽车尾气的污染物,用如图3装置可监测其含量,电池中每转移0.4mole﹣,Pt 电极消耗 L氧气(标况下)该装置的负极反应式为 .
-
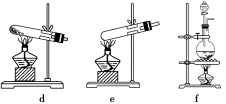
Ⅰ.氨气是一种重要化合物,在工农业生产、生活中有着重要应用.
(1)如图烧瓶中盛有Na2O2固体,分液漏斗中盛有浓氨水,利用图示仪器装置(加热及夹持固定装置均已略去)进行氨的催化氧化实验.请根据下列要求回答问题:
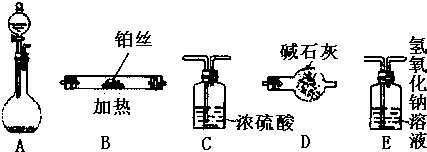
①请选择实验装置,按气流方向从左到右连接顺序是(填字母)______→______→______→E;
②试管B中的反应方程式为______△4NO+6H2O
-
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。
已知:




则 ______
______  ;
;
 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应:

 ,
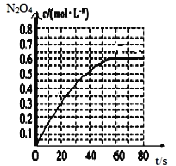
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。

 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位  ______。
______。
 在温度为
在温度为 、
、 时,平衡体系中
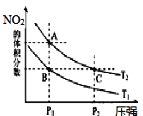
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。

下列说法正确的是______
 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅
 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法
 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
, ,则此时
,则此时 ______
______ 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL  溶液中滴加
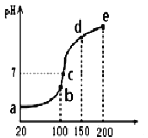
溶液中滴加 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

 水的电离程度最大的是______;
水的电离程度最大的是______;
 其溶液中
其溶液中 的数值最接近
的数值最接近 的电离常数K数值的是______。
的电离常数K数值的是______。
-
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。
已知:




则 ______
______  ;
;
 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应:

 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位  ______。
______。
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
下列说法正确的是______
 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅
 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法
 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
, ,则此时
,则此时 ______
______ 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL  溶液中滴加
溶液中滴加 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
 水的电离程度最大的是______;
水的电离程度最大的是______;
 其溶液中
其溶液中 的数值最接近
的数值最接近 的电离常数K数值的是______。
的电离常数K数值的是______。















 ______
______ 





