-
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCI4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.TiO2·xH2O高温分解得到TiO2。

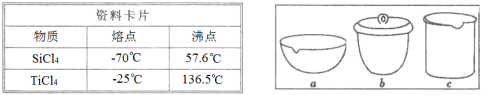
①根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是________,分离二者所采用的操作名称是________。
②Ⅲ中反应的化学方程式是________。
③如Ⅳ在实验室中完成,应将TiO2·xH2O放在________(填字母)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的________ (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”的部分原理。(夹持装置已略去)

①如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g,则CO的转化率为________。
②当CO气体全部通入后,还要按图示通一段时间空气,其目的是________。
-
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 |
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
| | |
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____;分离二者所采取的操作名称是____。
②Ⅲ中反应的化学方程式是________。
③如在实验室中完成步骤IV,应将TiO2•xH2O放在_____(填字母序号图 1)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或 水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的__________(填“氧化性”或“还原性”)。
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO 的转化率为________。
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是________。
-
【化学一选修2:化学与技术】(15分)纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装人氯化炉中,在髙温下通人Cl2,制得混有SiCl4杂质的TiCl4。
Ⅱ.将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
Ⅳ.TiO2•xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是 。Ⅱ中所采取的操作名称 。
②如实验IV中,应将TiO2•xH2O放在 (填仪器编号)中加热。
(2)据报道“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
 .O2 → 2O
.O2 → 2O
 .O + H2O → 2OH(羟基)
.O + H2O → 2OH(羟基)
 .OH + OH → H2O2
.OH + OH → H2O2
① b中破坏的是 (填“极性共价键”或“非极性共价键”)。
② H2O2能清除路面空气中的CXHY、CO等,其主要是利用了H2O2的 _(填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
①取10.00mL密度为 g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
MnO4- + H2O2 + H+ == Mn2+ + H2O + 
②滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
③重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为 。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 (填“偏髙”或“偏低” 或“不变”)。
-
(12分)
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV.TiO2·Xh2O高温分解得到TiO2。
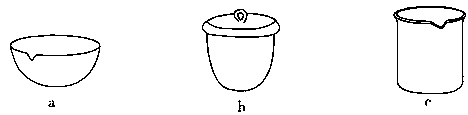
①TiCl4与SiCl4在常温下的状态是________。II中所采取的操作名称是________。
②III中反应的化学方程式是________。
③如IV在实验室完成,应将TiO2·xH2O放在________(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a. O2→2O b. O2+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是________(填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的________(填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为________。
②当CO气体全部通入后,还要通一会儿空气,其目的是________。
-
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4.
II.将SiCl4分离,得到纯净的TiCl4.
III.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O.
IV.TiO2•Xh2O高温分解得到TiO2.

①TiCl4与SiCl4在常温下的状态是______.II中所采取的操作名称是______.
②III中反应的化学方程式是______ TiO2•xH2O↓+4HCl
-
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上以金红石(主要成分是TiO2,主要杂质是SiO2)制取纳米级二氧化钛的流程如下:

| 资料卡片 |
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70 ℃ | 57.6 ℃ |
| TiCl4 | -25 ℃ | 136.5 ℃ |
| | |
(1)写出氯化时生成TiCl4的化学方程式________________________。
(2)操作Ⅰ、操作Ⅱ名称分别是______________、____________。
(3)写出TiCl4水解的化学方程式________________。
(4)如在实验室中完成灼烧TiO2·xH2O放在________(填字母序号)中加热。
(5)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的________(填“氧化性”或“还原性”)。
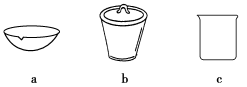
(6)某研究小组用下列装置模拟“生态马路”的部分原理并测定CO的转化效率(夹持装置已略去)。

①B装置中的药品名称为________,若通入2.24 L(已折算成标准状况)CO气体和足量空气,最终测得装置C增重1.1 g,则CO的转化率为________。
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是____________。
-
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 | | |
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |

Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
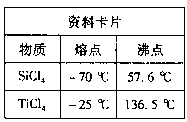
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____,分离二者所采取的操作名称是__。
(2) ③中反应的化学方程式是____________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。
(4) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
(5). 某研究性学习小组用图装置模拟“生态马路”清除CO的原理。(夹持装置已略去)若缓慢通入224L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为___ _________。

(6) 当CO气体全部通入后,还要通一会儿空气,其目的是 ________。
-
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 | | |
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。

Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。

Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
-
(1)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 _。
(2)用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图1 所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如图1 所示。该电解池的阳极反应式为 。
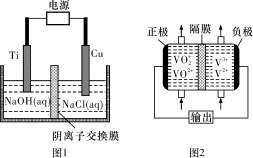
(3)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定某溶液中的含钒量,反应的离子方程式为:2VO +H2C2O4+
+H2C2O4+ 2H+===2VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L(保留一位小数)。
2H+===2VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L(保留一位小数)。
-
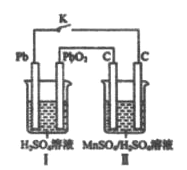
化学工业中Mn可用作氧化剂、助燃剂、活性电极材料、催化剂、油漆和油墨的干燥剂等,碳酸锰矿可作为制备MnO2原料
(1)已知25℃,101kPa时有如下的三个热化学方程式
①MnCO3(s)  MnO(s)+CO2(g) △H1=+116 6kJ/mol
MnO(s)+CO2(g) △H1=+116 6kJ/mol
②2MnO(s)+O2(g)  2MnO2(s) △H2=-272.0kJ/mol
2MnO2(s) △H2=-272.0kJ/mol
③2MnCO3(s)+O2(g)  2Mn2(s)+2CO2(g) △H3
2Mn2(s)+2CO2(g) △H3
则△H3=_________;反应②在________条件下(填“高温”、“低温”或“任何温度”)能自发进行。
(2)在密闭容器中投入足量的 MnCO3,在一定条件下发生反应:MnCO3(s)  Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
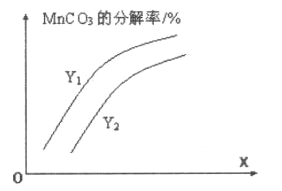
①温度、压强对碳酸锰平衡分解率的影响如图所示。图中Y1____Y2(填“>”、“<”或“=”)。
②保持温度不变,将体积扩大至原来的3倍,则容器内压强p(CO2)的变化范围为_______。
③若温度不变,将容器体积压缩至原来的一半,达到新平衡时,与原平衡状态相比,下列物理量一定不变的是________ (填字母)
A.CO2的质量 B. MnCO3的质量 C.MnCO3的分解率
D.化学平平衡常数 E.CO2的物质的量浓度
(3)在4L恒容密闭容器中,充入足量量的MnCO3(s)和a molO2(g),在一定温度下发生反应:MnCO3(s)+O2(g)  2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2mol・L-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2mol・L-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
(4)现以铅蓄电池为电源,用石墨为电极,电解MnSO4和H2SO4混合液来制备MnO2,装置如图所示,阳极的电极反应式为___________,当蓄电池中有2mol H+被消耗时,则理理论上能生成MnO2________g