-
本题为《化学反应原理(选修4)》模块选做题,每空2分,共20分。
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量。则表示H2燃烧热的热化学方程式是( )
A.H2(g) +1/2 O2(g)=H2O(g) ΔH =+285.8 kJ/mol
B.H2(g) +1/2 O2(g)=H2O(l) ΔH =-285.8 kJ/mol
C.H2(g) +1/2 O2(g)=H2O(l) ΔH =+285.8 kJ/mol
D.H2 +1/2 O2 =H2O ΔH =-285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是 (填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
反应达到平衡后,升高温度则反应速率 (填“增大”或“减小”);平衡将向 (填“正反应方向”或“逆反应方向”)移动。
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C Zn+CO↑,此法属 (填选项字母代号)。
Zn+CO↑,此法属 (填选项字母代号)。
A.电解法 B.热还原法 C.热分解法
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液 (B)0.1mol/LNH4Cl溶液
①溶液(A)的pH 7(填“>”、“<”或“=”);
②溶液(B)呈 性(填“酸”、“碱”或“中”),升高温度可以 (填“促进”或“抑制”)NH4Cl的水解。
-
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):

(1)对于氢氧燃料电池中,下列表达不正确的是________
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
-
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极):
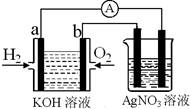
(1)对于氢氧燃料电池中,下列表达不正确的是________
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________ (溶液体积变化忽略不计)
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式正确的是________。
A.H2(g)+ O2(g)═H2O(g)△H=+285.8kJ/mol
O2(g)═H2O(g)△H=+285.8kJ/mol
B. H2(g)+ O2(g)═H2O(l)△H=﹣285.8kJ/mol
O2(g)═H2O(l)△H=﹣285.8kJ/mol
C. H2(g)+ O2(g)═H2O(l)△H=+285.8kJ/mol
O2(g)═H2O(l)△H=+285.8kJ/mol
D. H2+ O2═H2O△H=﹣285.8 kJ/mol
O2═H2O△H=﹣285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是______(填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)⇌2NH3(g) △H=﹣92.4 kJ/mol
反应达到平衡后,升高温度则反应速率_______(填“增大”或“减小”);平衡将向____________(填“正反应方向”或“逆反应方向”)移动。
-
(10分)化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
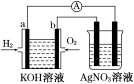
(1)对于氢氧燃料电池,下列叙述不正确的是________。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-===4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图右边装置中盛有AgNO3溶液,当氢氧燃料电池工作一段时间后,AgNO3溶液的pH_____________(填“增大”、“减小”或“不变”)。
(3)已知甲醇的燃烧热ΔH=-726.5 kJ/mol,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为_______________,正极的反应式为______________。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为__________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
-
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
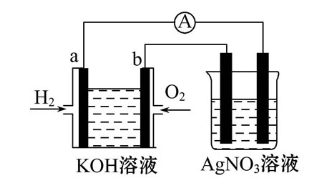
(1)对于氢氧燃料电池,下列表达不正确的是 。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100 mL 0.1 mol·L-1 AgNO3溶液,当氢氧燃料电池中消耗氢气112 mL(标准状况下)时,此时图中装置中溶液的pH= (溶液体积变化忽略不计)。
Ⅱ.已知甲醇的燃烧热ΔH为-726.5 kJ·mol-1,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。
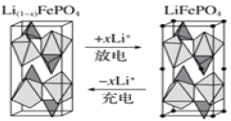
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。
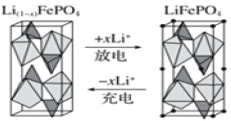
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
Ⅰ C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
Ⅳ C(s)+O2(g)=CO2
Ⅴ CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________。
A.容器内压强不再变化 B.H2与H2O(g)的物质的量之比不再交化
C.混合气体的密度不再变化 D.形成amolH-H键的同时断裂 2amolH-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
| 压强 温度 | p1/Mpa | p2/Mpa |
| 500℃ | 45.6% | 51.3% |
| 700℃ | 67.8% | 71.6% |
下列图像正确的是_________。
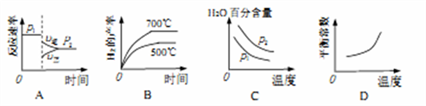
(3)已知反应Ⅱ的△H=-41.1kJ/mol, C=O、O-H、H-H的键能分别为803KJ/mol,464 kJ/mol、436kJ/mol,则 CO中碳氧键的键能为_________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为_________;当重新平衡后,CO2浓度_________(填“变大”“变小”“不变”)。
(5)氢镍电池具有无记忆、无污染,免维护等特点,被称为绿色电池。该电池的总反应为:H+NiOOH M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
| 压强 温度 | p1/Mpa | p2/Mpa |
| 500℃ | 45.6% | 51.3% |
| 700℃ | 67.8% | 71.6% |
由表中数据判断:p1 ______ p2(填“>”、“<”或“=”)
下列图像正确的是_________。
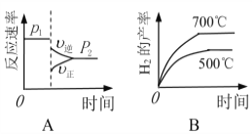
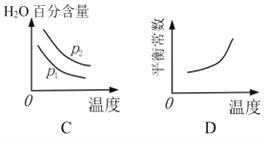
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________(填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________(填“变大”、“变小”或“不变”)。
2NH3(g) ΔH=-92.4 kJ/mol
Zn+CO↑,此法属 (填选项字母代号)。








