-
二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g)  CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。用 CH3OH 表示反应①的速率是_____________mo l·L-1·m i n -1,可逆反应②的平衡常数 K2=______________________。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是____。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
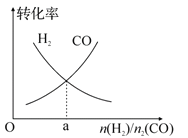
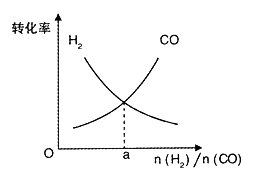
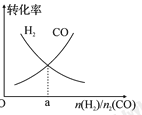
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图所示,则a=________ (填数值)。
(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为______________ 。

-
二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g)  CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。用 CH3OH 表示反应①的速率是_____________mo l·L-1·m i n -1,可逆反应②的平衡常数 K2=______________________。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是____。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
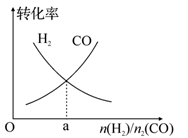
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图所示,则a=________ (填数值)。
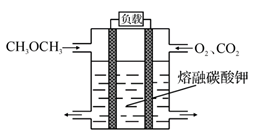
(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为______________ 。
-
二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g)  CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为___________________________________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。可逆反应②的平衡常数 K2=_____________________ _。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是________________________。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图1所示,则a=________ (填数值)。
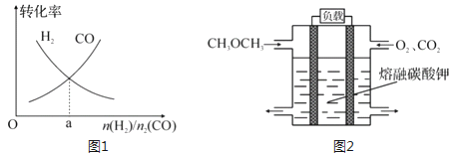
(5)绿色电源“二甲醚燃料电池”的结构如图 2 所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时负极的电极反应为______________ 。
(6)对于反应CO(g) + H2O(g)  CO2(g) + H2(g) △H1= + 41.2kJ/mol在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是______________。
CO2(g) + H2(g) △H1= + 41.2kJ/mol在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是______________。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
-
甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________kJ • mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______mol·L-1·min-1,可逆反应②的平衡常数K2=_________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________(填数值)。
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________。

-
二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) ∆H1
CH3OCH3(g)+H2O(g) ∆H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g) ∆H2=-90.7 kJ·mol-1
CH3OH(g) ∆H2=-90.7 kJ·mol-1
③2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H3
CH3OCH3(g)+H2O(g) ∆H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
则∆H1=__________kJ·mol-1、∆H3=__________kJ·mol-1
(2)反应①的化学平衡常数表达式为_____________。
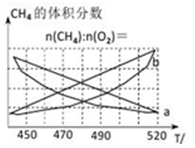
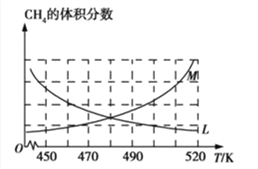
制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______________。
下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=_____________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因___________。
-
二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g) △H2=-90.7 kJ·mol-1
CH3OH(g) △H2=-90.7 kJ·mol-1
③2CH3OH(g) CH3OCH3(g)+ H2O(g) △H3
CH3OCH3(g)+ H2O(g) △H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1453.0 kJ·mol-1;1mol 液态水变为气态水要吸收44.0kJ的热量。反应③中的相关的化学健键能数据如表:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ • mol-1) | 436 | 343 | 465 | 453 | 413 |
则△H1=_________kJ·mol-1 △H3=_________ kJ·mol-1
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4 的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500 K时的2 L的密闭容器中充入2mol CO和6 molH2,8 min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___v(逆),说明原因____________________。
-
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG) 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成气制备二甲醚:
②CO(g) +2H2(g) CH3OH(g) △H2=- 90.7 kJ/mol
CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g) CH3OCH3(g) +H2O(g) △H3
CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
| 化学键 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
| E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |
△H3=_______kJ/mol。
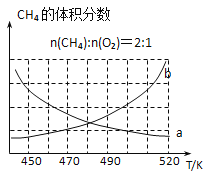
(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______。下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是______;可逆反应③的平衡常数K=_______。若在500K 时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v ( 正)______v (逆),说明原因________________。
-
二甲醚CH3OCH3又称甲醚,简称DME, 熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的淸洁燃料“。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1 =-90.0 kJ·mol-1
CH3OH(g) △H1 =-90.0 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
回答下列问题:
(1)反应①在_____________(填“低温”或“高温”)下易自发进行。
(2)写出由合成气(CO、H2)直接制备CH3OCH3的热化学方程式:______________。
(3)温度为500K时,在2L的密闭容器中充入2mol CO和6molH2发生反应①、②,5min时达到平衡,平衡时CO的转化率为60%,c(CH3OCH3) = 0.2 mol·L-1,用H2表示反应①的速率是________,反应②的平衡常数K=____________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_____v逆(填“>”、“<”或“=”)。
(4)研究发现,在体积相同的容器中加入物质的量相同的CO和H2出发生反应①、②,在不同温度和有无催化剂组合下经过相同反应时间测得如下实验数据:
| T (K) | 催化剂 | CO转化率(%) | CH3OCH3选择性(%) |
| 473 | 无 | 10 | 36 |
| 500 | 无 | 12 | 39 |
| 500 | Cu/ZnO | 20 | 81 |
【备注】二甲醚选择性:转化的CO中生成CH3OCH3百分比
①相同温度下,选用Cu/ZnO作催化剂,该催化剂能_______ (填标号)。
A.促进平衡正向移动 B.提高反应速率 C.降低反应的活化能
D.改变反应的焓变 E.提高CO的平衡转化率
②表中实验数据表明,在500K时,催化剂Cu/ZnO对CO转化成CH3OCH3的选择性有显著的影响,其原因是__________________________。
-
二甲醚又称甲醚,简称 DME,熔点 ,沸点
,沸点 ,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(
,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气( )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①
②
回答下列问题:
(1)已知: ,若由合成气(
,若由合成气( ) 制备
) 制备  ,且生成
,且生成 ,其热化学方程式为_______________。
,其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入 和
和 . 5min达到平衡,平衡时测得
. 5min达到平衡,平衡时测得 ,
, ,此时
,此时 的转化率为___________。用
的转化率为___________。用  表示反应①的速率是_____________
表示反应①的速率是_____________ ,可逆反应②的平衡常数
,可逆反应②的平衡常数  =_______________________
=_______________________
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 值变小,则下列说法正确的是_________________ 。
值变小,则下列说法正确的是_________________ 。
A. 平衡向正反应方向移动
B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变
D. 容器中 的体积分数减小
的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 和
和 进行反应①,平衡时
进行反应①,平衡时 和
和 的转化率如图所示,则a=________ (填数值)。
的转化率如图所示,则a=________ (填数值)。
(5)用活性炭还原法处理氮氧化物的有关反应为: 。向恒容密闭容器中加入一定量的活性炭和
。向恒容密闭容器中加入一定量的活性炭和 ,恒温(
,恒温( )时,各物质的浓度随时间的变化如下表:
)时,各物质的浓度随时间的变化如下表:
| 浓度/ 时间/min | 
| 
| 
|
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
在31 min时,若只改变某一条件使平衡发生移动,40 min,50 min时各物质的浓度如上表所示,则改变的条件是__________________。
在51 min时,保持温度和容器体积不变再充入 和
和 ,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
-
二甲醚又称甲醚,简称DME,熔点 ,沸点
,沸点 ,与石油液化气
,与石油液化气 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
相似,被誉为“21世纪的清洁燃料”。制备原理如下:
(I)由天然气催化制备二甲醚:① ;
;
(II)由合成气制备二甲醚:
②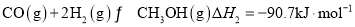 ;
;
③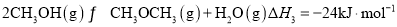 。
。
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是 和
和 ;
; 液态水变为气态水要吸收
液态水变为气态水要吸收 的热量。则
的热量。则 ________
________ 。
。
(2)反应③的化学平衡常数表达式为 ________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按
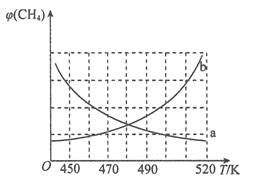
________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按 混合,图中能正确反映反应①中
混合,图中能正确反映反应①中 的平衡体积分数随温度变化的曲线是________。下列能表明反应①达到化学平衡状态的是________
的平衡体积分数随温度变化的曲线是________。下列能表明反应①达到化学平衡状态的是________ 填字母
填字母 。
。
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和 ,此时体系总压强是
,此时体系总压强是 。8min达到平衡,平衡时CO浓度为
。8min达到平衡,平衡时CO浓度为 ,
, ,则CO的转化率为________,用平衡分压表示可逆反应③的平衡常数
,则CO的转化率为________,用平衡分压表示可逆反应③的平衡常数 ________
________ 分压
分压 总压
总压 物质的量分数
物质的量分数 。
。
(4)在500K时的2L的密闭容器中充入 ,发生反应③,容器的总压强为4000kPa,反应5min后达到平衡,
,发生反应③,容器的总压强为4000kPa,反应5min后达到平衡, ,用单位时间甲醇的分压变化表示该反应的反应速率为________。
,用单位时间甲醇的分压变化表示该反应的反应速率为________。
CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1

CO2(g) + H2(g) △H1= + 41.2kJ/mol在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是______________。










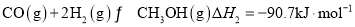 ;
;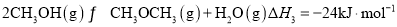 。
。