-
A、B、C、D、E都是前四周期元素,A原子价电子排布式为nsnnPn,B原子核外有3种能量不同的电子,B、C同主族,B与C形成的一种化合物是形成酸雨的重要物质。D原子核外电子有11种不同的运动状态。E是前四周期中原子核外成单电子数最多的元素。
回答下列问题:
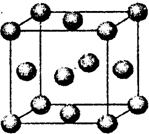
(1)元素A的一种单质的结构如图所示。
其中A - A-A键之间的夹角是____________,含有1mol A的该单质中,形成的共价键有____mol。
(2)等径圆球在二维空间里可形成密置层和非密置层排列。在二维空间里D晶体的配位数是_______。
(3) E的基态原子的外围电子排布式为_______,AC2的电子式为 _______________。
(4)下列关于AB2的晶体和冰的比较中正确的是______(填标号)。
a.晶体的密度:AB2的晶体 > 冰
b.晶体的熔点:AB2的晶体 >冰
c.晶体中的空间利用率:AB2的晶体 >冰
d.晶体中分子间相互作用力类型相同
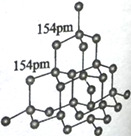
(5)D2C的晶胞如图,设晶体密度是ρg/㎝3
①比较D2C与D2B的熔点,较高的是_______(填化学式),其原因是 ___________________。
②试计算●与〇的最短距离______(只写出计算式,阿伏加德罗常数的值用NA表示)。
-
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
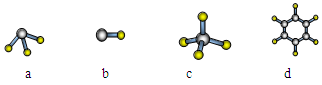
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有________种不同运动状态的电子,该原子核外共有________种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号)________。
(2)下列变化规律中正确的是 ________。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为________ ,E的化学式为________。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33 | 164 |
-
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________,它们的稳定性由弱到强的顺序是________。
B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
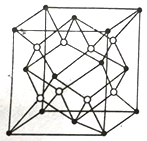
(6)E的三种同素异形体,晶胞如图所示:
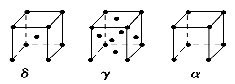
其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
-
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________(写分子式),它们的稳定性由弱到强的顺序是________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示:

其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
-
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置 ;E元素价电子排布式为 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是 (写分子式)。
(3)B与D形成的非极性分子的电子式为________。
(4)B、C、D三种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
(5)C的单质分子中σ键和π键的个数比为________。
(6)已知在25℃、101kPa下:ABC(aq)+A2D(1)BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(1)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示): 。
-
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
-
已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能由大到小的顺序排列为 (用元素符号表示)。
(4)C的单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有 (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为 ;B和E的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方最密堆积,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为acm,则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
-
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)C的同周期相邻元素的第一电离能由小到大的顺序为______
(2)氢化物A2H4分子中A原子采取______杂化
(3)元素F在周期表的位置为______,E的气态氢化物通入二价阳离子F2+的水溶液反应的离子方程式为______
(4)元素A和D可形成一种无机非金属材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为______(从原子轨道重叠方式看),A、D的最高价氧化物的熔沸点大小顺序_________;原因________。
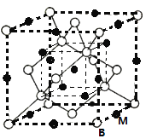
(5)B与同主族原子半径最小的元素M形成的晶胞结构所示的立方晶胞,则其化学式为______。设阿伏加德罗常数为NA,距离最近的两个B、M原子的核间距为a nm,则该化合物的晶胞密度为(用含a和NA的代数式表示)______g/cm3
-
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第________周期第________族,其基态原子最外层有________个电子。
(2)X的第一电离能比Y的________(填“大”或“小”),1mol X22-中含有的 键数目为________。
键数目为________。
(3)X和Y的气态氢化物中,较稳定的是________(写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是________。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ•mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ•mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为________。
-
化学一一选修物质结构与性质
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子核外部分电子排布式为:NsnNpn;B原子核外2P轨道有3个未成对电子:C原子核外S能级电子总数和P能级电子总数相同,且P能级成对电子数等于未成对电子数:D原子核外M层全充满,N层只有1个电子.
请回答:
(1)B元素外围电子排布图为:______.
(2)A、B、C的第一电离能由大到小顺序为______,电负性由大到小顺序为______(用元素符号回答).
(3)B和C两元素形成的阴离子BC-3中B的杂化类型为______,空间构型为______.
(4)与BC-3互为等电子体且含有A、C两元素的微粒是______.(写化学式)
(5)比较A、B的氢化物在水中溶解度大小并说明原因______.
(6)D元素基态原子电子排布______,该元素单质形成的晶体晶胞如图所示,则D元素单质的堆积方式为______,已知D原子半径为r,相对原子质量为Mr,则D元素单质的密度可表示为______