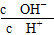-
25 ℃时,电离平衡常数:
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 3.0× | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
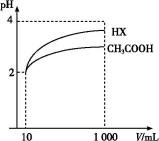
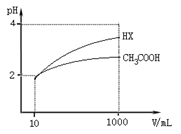
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ________ ________ ;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
-
25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| | | | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___________(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH) C.c(H+)/ KW D.c(H+)/c(OH-)
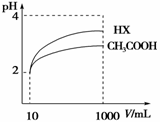
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数___________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的 c(H+)______________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或 “小于”)
-
25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是________________;(填编号)
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_____;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是__________________,
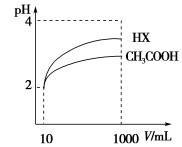
稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”),理由是:__________________;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________。(填准确数值)
-
25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是______________(填编号);
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B.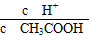 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.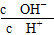
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是__________________________________________,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:____________________________________;
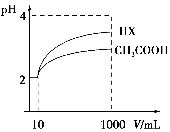
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
-
(11分)25℃时,电离平衡常数:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1 4.3×10-7 3.0×10-8
K2 5.6×10-11
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa
d.NaHCO3;PH由大到小的顺序是:_______________________;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:____________________;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D. c(OH-)/(H+)
(3)体积为10mLPH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程PH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_____________________________________________________________________,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________________________________________;
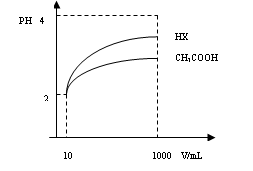
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液PH=6,则溶液中
c(CH3COO-)-c(Na+)=_______________________。(填准确数值)
-
25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7
K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:________;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是________,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:________;
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO-)-c(Na+)=________.(填准确数值).
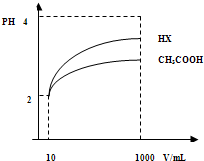
-
25℃时,三种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___mol·L-1(填精确数值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”,下同)醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
-
25℃时,三种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka (填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是 (填序号);
a. CO32- b. ClO- c. CH3COO- d. HCO3-
(3)下列反应不能发生的是 (填序号)
a. CO32-+CH3COOH=CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号);
a. b. c. d.
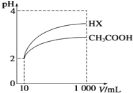
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
则HX的电离平衡常数________(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+),理由是___________________;
(6)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确数值)。
-
25 ℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.0×10-8 |
回答下列问题。
(1)物质的量浓度为0.1 mol·L-1的下列四种物质,pH由大到小的顺序是________(填编号)。
a.Na2CO3 b.NaClO
c.CH3COONa d.NaHCO3
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列各量一定变小的是________(填编号)。
A.c(H+) B.c(CH3COO-)
C.c(H+)·c(OH-) D.
(3)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是__________________;稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_________________________________________________________________。

(4)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填精确数值)。
-
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的 =___________
=___________
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
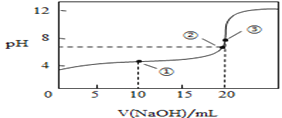
①在滴定的实验过程中,不需要的仪器或用品是________(填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是 _________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________ c(CH3COOH)+c(H+)(填“ ”“
”“ ”或“
”或“ ”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______mol/L,此时溶液中c(CrO42-)等于_________mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。




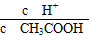 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.