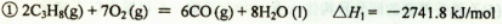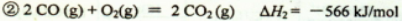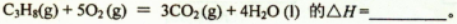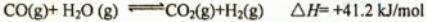-
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g) △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H = -566 kJ/mol
③H2O(l) = H2O(g) △H = + 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O | CO | CO2 | H2 |
| 甲 (质量/g) | 1.8 | 8.4 | a | 1 |
| 乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是 ;达到平衡
时,乙容器中CO的转化率为 。
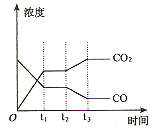
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
-
(12分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) = 6CO(g) + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的 △H=________
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  CO2(g) + H2(g) △H1= + 41.2kJ/mol
CO2(g) + H2(g) △H1= + 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=________,此过程吸收的热量为________________________.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为________。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____________。
-
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H =+ 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式________________________________________________________________________________________________________________________________________________________________________ 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O | CO | CO2 | H2 |
| 甲 (质量/g) | 1.8 | 8.4 | a | 1 |
| 乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是________________________________________________________________ ;达到平衡时,乙容器中CO的转化率为________________________________________________________________ 。
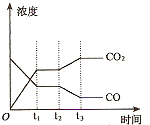
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是________________________ ________、________________________ (答两个要点即可)。
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ________________________________________________________________________________ ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) =________________________________________________________________________ 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) =________________________________________________________________________________________________________________________________________________________________________________ [用含c(HCO3-)、c(H2CO3)的符号表示]。
-
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O (l)△H1=﹣2741.8kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=﹣566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) 的△H= 。
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H=+41.2kJ/mol
CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是 。
a.体系中的压强不发生变化
b.V正(H2)=V 逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2O)= ;此时该反应的平衡常数K为 。
③向平衡体系中充入少量CO则平衡常数K (填“增大”、“减小”或“不变”)
依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2﹣,电池内部O2﹣由 极移向 极(填“正”或“负”);电池的负极电极反应式为 。
(3)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极区的现象为 。
-
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O (l)△H1=-2741.8kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566kJ/mol
(1)反应C3H8(g)+5O2(g)═3CO2(g)+4H2O (l) 的△H=________.
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O (g)⇌CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是________.
a.体系中的压强不发生变化
b.v 正(H2)=v 逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=________.
③向平衡体系中充入少量CO则平衡常数________(填“增大”、“减小”或“不变”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-由________极移向________极(填“正”或“负”);电池的负极电极反应式为________.
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为________.
-
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g)  CO2(g) +H2 (g)
CO2(g) +H2 (g)
①下列事实能说明该反应达到平衡的是________
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO )
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件________,第5~6min之间,改变的条件是________。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为________。又知397℃时该反应的平衡常数为12,请判断该反应的△H________0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;
燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向____________极(填“正”或“负”);电池的负极反应式为________。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____________。
-
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) + 7O2 (g)= 6CO(g) + 8H2O(l) △H1=-2741.8 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) △H2 =-566 kJ/mol
(1) 反应C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O (1) 的△H=_______。
(2) 现有lmol C3H8 在不足量的氧气里燃烧,生成1mol CO 和2mol CO2 以及气态水,将所有的产物通入一个固定体积为1L 的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O (g)  CO2(g)+H2(g) △H= +4 1.2 kJ/mol
CO2(g)+H2(g) △H= +4 1.2 kJ/mol
①下列事实能说明该反应达到平衡的是______
a.体系中的压强不发生变化
b.v正(H2) = v逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min 后体系达到平衡,经测定,H2 为0.8mol,则平衡常数K=_______。
③其他条件不变,向平衡体系中充入少量CO 则平衡常数_____ (填增大、减小或不变)。
(3) 依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-由______极移向______ 极(填“正”或“负”);电池的负极电极反应式为____________。
(4) 用上述燃料电池和惰性电极电解足量Mg(NO3)2 和NaCl 的混合溶液。电解开始后阴极的现象为____________________________。
-
丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:
①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l)△H1=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=______.
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H1=+41.2kJ/mol,5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=______,此过程吸收的热量为______.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-由______极移向______极(填“正”或“负”);电池的负极电极反应式为______.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为______.
-
丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g)=6CO(g)+8H2O(1) △H1 =-2741.8 kJ•mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJ•mol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) △H=____________;
(2)现有1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=+41.2kJ•mol-1
①下列事实能说明该反应达到平衡的是_____________;
a.体系中的压强不再变化 b.v正( H2) = v逆( CO ) c.混合气体的平均相对分子质量不再变化 d.CO2 的浓度不再发生变化
②5min 后体系达到平衡,经测定,容器中含 0.8 mol H2,则平衡常数K =______;
③其他条件不变,向平衡体系中充入少量CO,则平衡常数K______(填“增大”、“减小”或“不变”)
(3)根据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体 ;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向______极移动(填“正”或“负”);电池的负极电极反应为________。
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为___________。
-
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
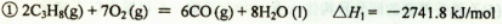
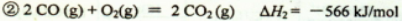
(1)反应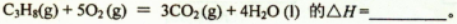
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
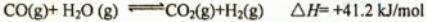
①下列事实能说明该反应达到平衡的是 ,
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
CO2(g)+H2(g)△H=+41.2kJ/mol