-
(1)某学生用KMnO4制备氯气,反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
当有15.8g KMnO4参加反应时,消耗________molHCl,其中被氧化的HCl有________ mol,有________mol电子转移,标准状况下生成Cl 2的体积为________L。
(2)生成的氯气缓慢通入KI-淀粉溶液中,出现蓝色,离子方程式为________,若氯气用量(物质的量)达到KI的3倍时,蓝色完全消失,已知此时生成物中含碘物质只有一种,那么该物质中碘的化合价为________。
高一化学填空题中等难度题查看答案及解析
-
实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
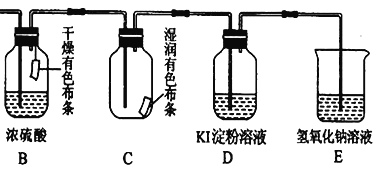
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
高一化学综合题中等难度题查看答案及解析
-
实验室迅速制备少量氯气可利用如下所示的反应
2KMnO4 +16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ; 当参加反应的氧化剂的物质的量是1mol时,回答下列问题:
(1)被氧化的还原剂的物质的量是多少?
(2)产生标准状况下的氯气的体积多少升?
高一化学计算题简单题查看答案及解析
-
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 + 16HCl(浓)="=" 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O。下列叙述错误的是( )
A.氧化剂是KMnO4
B.反应过程中,Cl元素化合价升高,HCl被氧化
C.当有0.10 mol电子发生转移时,生成的氯气的体积为2.24 L(标准状况)
D.当生成2.24L(标准状况)氯气时,反应消耗HCl的物质的量为0.32mol
高一化学选择题中等难度题查看答案及解析
-
(14分)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 +16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是 。
(3)KMnO4的氧化性比Cl2的氧化性 (选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为 L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、 。
②应用托盘天平称取KMnO4固体 g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) 。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.颠倒摇匀后发现凹液面低于刻度线又加水补上
D.在溶解过程中有少量液体溅出烧杯外
高一化学实验题中等难度题查看答案及解析
-
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(1)在该反应中,氧化剂是________,还原剂是________。
(2)当有0.10mol电子发生转移时,生成氯气的体积为________(标准状况),发生反应的KMnO4的质量为________。
高一化学填空题简单题查看答案及解析
-
实验室用 KMnO4 与密度为 1.19 g·cm-3,溶质质量分数为 36.5%的 HCl 溶液反应制取氯气,反应方程式为:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2 + 5Cl 2↑ + 8H2O
(1)用双桥线法分析电子转移的方向和数目____________(直接在上述方程式中表示);
(2)氧化剂_____________ 氧化产物________________
(3)若反应中有 0.5 mol 电子转移,被氧化的 HCl 的物质的量是__________ mol;
(4)c(HCl)=_________________________________ ;
高一化学填空题中等难度题查看答案及解析
-
实验室可用如下反应制取氯气,反应原理如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比________
(3)15.8g KMnO4能使多少克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为多少?(
高一化学计算题简单题查看答案及解析
-
实验室中可用如下反应制取氯气:2KMnO4 + 16HCl (浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O,此反应中氧化剂与还原剂的物质的量之比为
A.1︰8 B.5︰2 C.1︰5 D.5︰1
高一化学选择题中等难度题查看答案及解析
-
(14分)用浓盐酸来制取氯气的化学方程式如下:2KMnO4 +16HCl =2KCl +2MnCl2 + 5Cl2↑+8H2O,其中被还原的元素是________,被氧化的元素是________,氧化剂是________,还原剂是________,氧化产物是________,还原产物是,假如有2.5 mol Cl2生成,则该反应中电子转移数目为___________________。
高一化学填空题简单题查看答案及解析