-
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g)= CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为________。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________(填序号),其原因是。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。

① 0<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为________ ;
③ V=67.2 L时,溶液中离子浓度大小关系为________。
-
(14分)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g) = CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为________________________。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________________________(填序号),其原因是________________________。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________________________。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
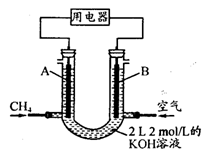
① O<V≤44.8 L时,电池总反应方程式为________________________ ;
② 44.8 L<V≤89.6 L时,负极电极反应为________________________ ;
③ V=67.2 L时,溶液中离子浓度大小关系为________________________。
-
(14分)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g) = CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为________________________。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________________________(填序号),其原因是________________________。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 
(4)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
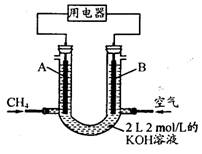
① O<V≤44.8 L时,电池总反应方程式为________________________ ;
② 44.8 L<V≤89.6 L时,负极电极反应为________________________ ;
③ V=67.2 L时,溶液中离子浓度大小关系为________________________。
-
(14分)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g) = CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为________________________。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________________________(填序号),其原因是________________________。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________________________。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。

① O<V≤44.8 L时,电池总反应方程式为________________________ ;
② 44.8 L<V≤89.6 L时,负极电极反应为________________________ ;
③ V=67.2 L时,溶液中离子浓度大小关系为________________________。
-
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为________。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是________。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是________。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为________。
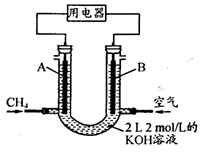
② 44.8 L<V≤89.6 L时,负极电极反应为________。
③ V=67.2 L时,溶液中离子浓度大小关系为________。
-
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
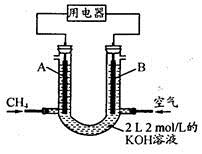
① 0<V≤44.8 L时,电池总反应方程式为 。
② 44.8 L<V≤89.6 L时,负极电极反应为 。
③ V=67.2 L时,溶液中离子浓度大小关系为 。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
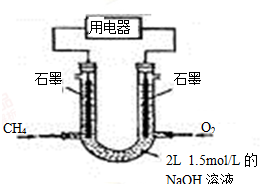
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析作为合成甲醇更适宜的是反应 。(填序号)
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
①0<V≤33.6L时,负极电极反应为 。
②33.6L<V≤67.2L时,电池总反应方程式为 。
③V=44.8L时,溶液中离子浓度大小关系为 。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ |
| N2 | H2 | NH3 |
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
| | | | | |
下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
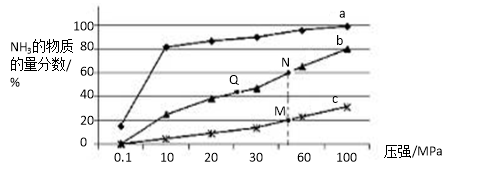
①上图中M、N、Q点平衡常数K的大小关系是 。
②M点对应的H2转化率是 。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+ O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
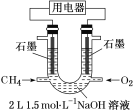
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ |
| N2 | H2 | NH3 |
| Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
| Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。
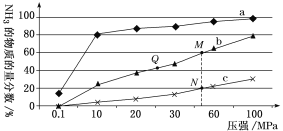
①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析四个反应,作为合成甲醇更适宜的是反应 。(填序号)
(3)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
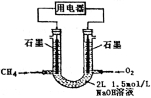
①0<V≤33.6L时,负极电极反应为 。
②33.6L<V≤67.2L时,电池总反应方程式为 。
③V=44.8L时,溶液中离子浓度大小关系为 。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ |
| N2 | H2 | NH3 |
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
| | | | | |
①容器①中,0-t1时间的平均反应速率为υ(H 2)= 。
2)= 。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。
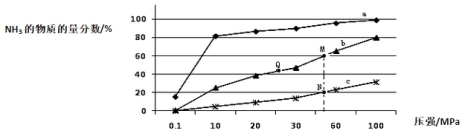
①曲线a对应的温度是 。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是 。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
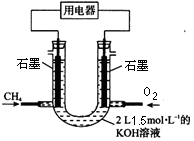
①0<V≤33.6L时,负极电极反应为 。
②V=44.8L时,溶液中离子浓度大小关系为 。
(3)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 能量的变化/kJ |
| N2 | H2 | NH3 |
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
| | | | | |
①容器①中,0-t1时间的平均反应速率为υ(H2)= 。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(4)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。
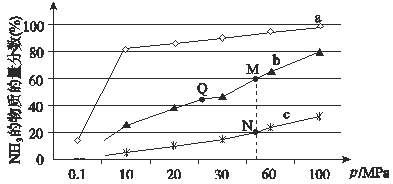
①曲线a对应的温度是 。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是 。













