-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2 + 11O2  8SO2 + 2Fe2O3,该反应中被氧化的元素是_________(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为_________L.
8SO2 + 2Fe2O3,该反应中被氧化的元素是_________(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为_________L.
(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
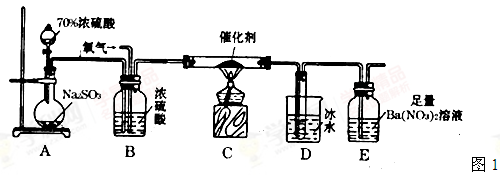
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是____________.
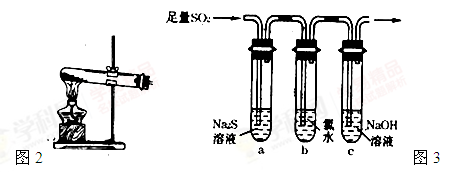
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式____________.
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是____________.
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是____________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为____________.
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成 三份,分别进行如下实验:
三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是_______________(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__________________.
-
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。

(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
-
工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
黄铁矿(FeS2) SO2
SO2 气体B
气体B 硫酸
硫酸
关于工业制硫酸的说法不正确的是
A.煅烧时FeS2发生氧化反应 B.A可以是空气
C.步骤②产物中有SO3 D.步骤③发生了氧化还原反应
-
硫及其化合物是重要的工业原料,探究其性质具有非常重要的意义。
(1)某学习小组设计用如图装置验证二氧化硫的化学性质。
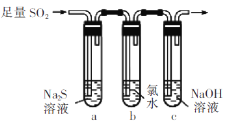
①能说明二氧化硫具有氧化性的实验现象为_________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案II:向第二份溶液中加入品红溶液,红色褪去
方案III:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是_____(填“I”、“II”或“III”);试管b中发生反应的离子方程式为_____。
(2)利用如图装置可以验证硫和氯非金属性的强弱。

①仪器A的名称为__________,干燥管D的作用是__________。
②实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为__________、__________、__________;装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_______。
-
工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:

回答下列问题:
(1)在接触室中发生的反应是2SO2+O2 2SO3,该反应属于__________(填字母)
2SO3,该反应属于__________(填字母)
a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)Fe2O3废渣的用途有________________________(答出一条即可)。
(3)写出沸腾炉中发生反应的化学方程式:________
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是_____。
-
硫铁矿【主要成分是二硫化亚铁(FeS2)】是一种重要的化工原料,常用来制备铁、硫酸和氯化铁,其工业流程示意图如图.(资料:Fe+2FeCl3=3FeCl2)
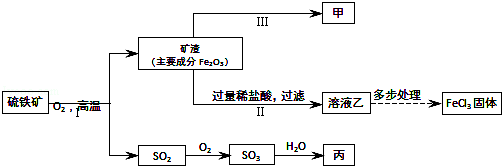
(1)Ⅱ中反应的化学方程式是 .
Ⅲ中反应的化学方程式是 .
(2)结合上述流程,硫铁矿中硫元素的化合价 ,如图出现的含硫元素的物质中,属于氧化物的有 (填化学式).
(3)若向溶液乙和丙的稀溶液中分别加入足量的甲,观察到的现象不同点是
-
下列关于工业生产的说法中,正确的是( )
A.工业上用氧气在接触室中氧化黄铁矿得到二氧化硫
B.工业上通过电解饱和氯化钠溶液制备金属钠
C.工业用氨氧化法制硝酸是人工固氮过程
D.生产普通玻璃的主要原料有石灰石、石英和纯碱
-
化学工艺即化工技术或化学生产技术,指将原料物主要经过化学反应转变为产品的方法和过程,包括实现这一转变的全部措施。工业上用赤铁矿(含 、
、 ,也含有
,也含有 、
、 、
、 、
、 等)制备绿矾
等)制备绿矾 的工艺流程如下图:
的工艺流程如下图:
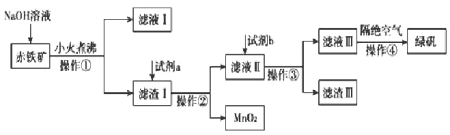
(1)操作①的名称是______________。
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_________、__________。
(3)向滤渣Ⅰ中加入过量的试剂a名称为__________,加入过量试剂b后所得滤渣Ⅲ的主要成分化学式为__________。
(4)操作③需要的玻璃仪器主要包括________________。
(5)操作④需要隔绝空气的主要原因可能是什么?___________________________。
-
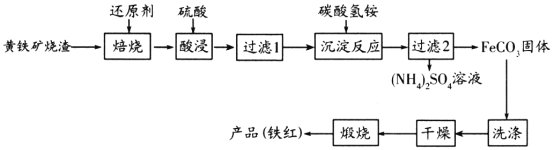
黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时反应温度不宜过高,其原因为________(用化学方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示: )
)
-
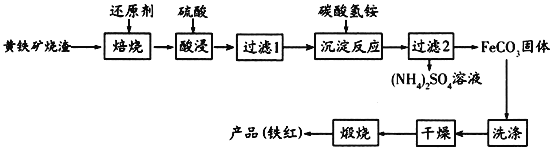
黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示: )
)
8SO2 + 2Fe2O3,该反应中被氧化的元素是_________(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为_________L.


三份,分别进行如下实验:







