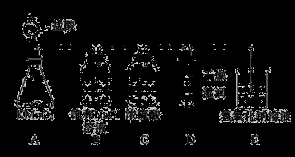-
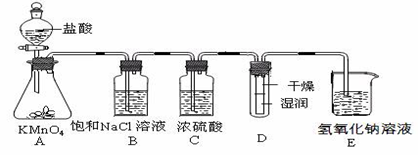
(12分)工业上将纯净干燥的氯气通入到0.5 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2。(装置D中纸条为红色)
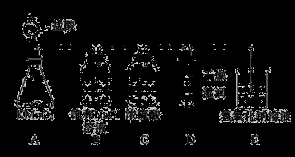
(1)配平KMnO4与盐酸反应的化学方程式:
KMnO4+ HCl(浓) = KCl + MnCl2+ Cl2↑+ H2O
(2)如果反应中转移0.5mol电子,则生成Cl2的物质的量为____________。
(3)浓硫酸的作用是 。
(4)实验时装置D中的现象是 。
(5)装置E中发生化学反应的离子方程式为 。
(6)配制480 mL物质的量浓度为0.5 mol·L-1NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 ,需称量的NaOH的质量是 。
-
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
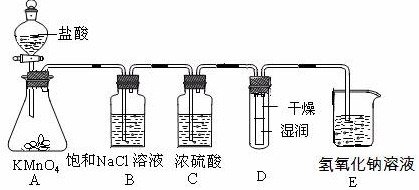
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是________。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
________ ;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
-
工业上将纯净干燥的氯气通入到0.5 mol·L-1 NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2。(注:装置D中布条为红色)

(1)用装置A制备Cl2,该同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未顺利流下,你认为原因可能是:__________________。
(2)配平KMnO4与盐酸反应的化学方程式:
KMnO4+ HCl(浓) = KCl + MnCl2+ Cl2↑+ H2O ,该反应中氧化剂和还原剂的物质的量之比为________。
(3)饱和食盐水的作用是______________,浓硫酸的作用_____________,装置E的作用是_______________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
(5)配制450 mL物质的量浓度为0.4 mol·L-1 NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 ,需用托盘天平称量NaOH的质量是 。
-
工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水。某同学想在实验室探究Cl2性质
并模拟制备漂水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
(1)配制物质的量浓度为0.375 mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应的离子方程式为 。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2
中HCl气体的原理(用离子方程式表示和文字说明) 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,
可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因 ;
如需改进,请简述设计方案 (若认为合理。则此问可不答)。
-
下列关于工业生产的说法正确的是
A. 工业上以氯气和澄清石灰水为原料制造漂白粉
B. 工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
C. 工业上将氯气溶于NaOH溶液制备漂白粉
D. 漂白粉要干燥和密封保存
-
(8分)某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验:
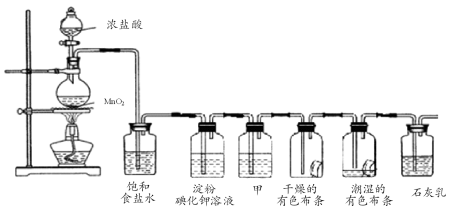
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是 ,反应的离子方程式为 。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放 (填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为 。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2 L。
-
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图
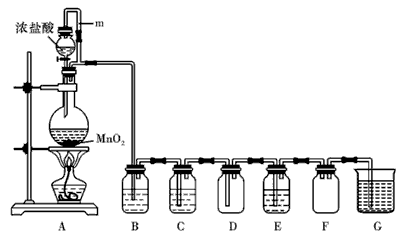
(1)圆底烧瓶中发生反应的化学方程为
(2)若要得到干燥纯净的气体,则B中应盛放的试剂是 C中应盛放的试剂是
(3)E中若装有淀粉碘化钾溶液,能观察到的实验现象是
(4)G中发生反应的化学方程式为
-
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究 Cl2 的漂白性。
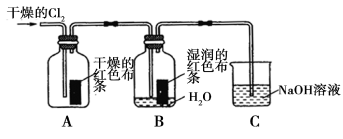
① 通 入Cl2 后 , 观 察 到 的 现 象 是 根 据 现 象 可 得 出 的 结 论是 。
②集气瓶 B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究 Cl2 的氧化性。
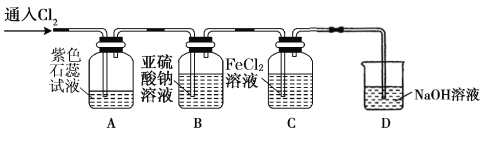
①实验开始后,观察装置 A 中的现象是 。
②装置 C 中发生反应的离子方程式是 。
③停止通入氯气,取装置 B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入 Cl2 时装置 B 中发生 反应的离子方程式是 。
-
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
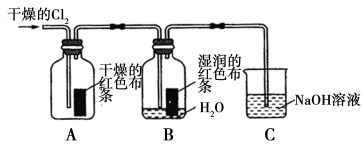
①通入Cl2后,观察到的现象是 根据现象可得出的结论是______。
②集气瓶B发生反应的离子方程式是______。
③C装置的作用是______,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
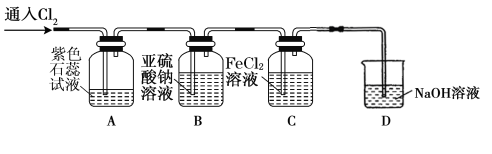
①实验开始后,观察装置A中的现象是: 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是 。
-
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
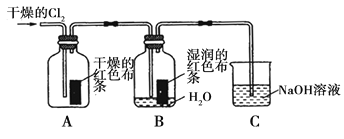
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
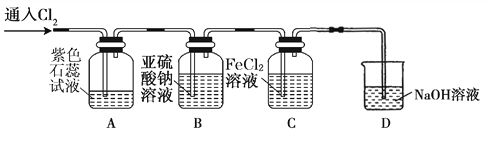
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。