-
在101 kPa和298 K时,有关反应的热化学方程式有:H2(g)+  O2(g)=H2O(g) △H1=-241.8 kJ·mol-1,
O2(g)=H2O(g) △H1=-241.8 kJ·mol-1,
H2(g)+  O2(g)=H2O(l) △H2=-285.8 kJ·mol-1,
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1,
下列说法错误的是
A. H2燃烧生成1mol H2O(g)时,放出241.8 kJ的热量
B. O2前面的 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C. 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ
D. 1mol液态水变成水蒸气时吸收44 kJ的热量
-
在101 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+ O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则 H2的燃烧热为285.8 kJ·mol-1
D.1 mol H2和 mol O2所具有的总能量大于1mol H2O(g)所具有的总能量
mol O2所具有的总能量大于1mol H2O(g)所具有的总能量
-
在101 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+ O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则 H2的燃烧热为285.8 kJ·mol-1
-
在101kPa和25℃时,有关反应的热化学方程式如下:C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) △H2=-241.7kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)△H3=-285.8 kJ·mol-1下列说法正确的是( )
A. C(s)+H2O(g)=CO(g)+H2(g) △H=-131.2kJ·mol-1
B. H2燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
C. 2H2O(g)=2H2(g)+O2(g) △H=-483.4kJ·mol-1
D. H2O(g)=H2O(l) △H=-44.1kJ·mol-1
-
在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g) =CO(g) ΔH1=-110.5 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(g) ΔH2=-241.7 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
下列说法正确的是
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.2 kJ·mol-1
B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.2H2O(g)=2H2(g)+O2(g) ΔH=-483.4 kJ·mol-1
D.H2O(g)=H2O(l) ΔH=-44.1 kJ·mol-1
-
在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g) =CO(g)ΔH1=-110.5 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(g)ΔH2=-241.7 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l)ΔH3=-285.8 kJ·mol-1
下列说法正确的是( )
A. C(s)+H2O(g)=CO(g)+H2(g)ΔH=-131.2 kJ·mol-1
B. H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O (l)ΔH=-571.6 kJ·mol-1
C. 2H2O(g)=2H2(g)+O2(g)ΔH=-483.4 kJ·mol-1
D. H2O(g)=H2O(l)ΔH=-44.1 kJ·mol-1
-
在101kPa和25℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g)===CO(g)ΔH1=-110.5kJ·mol-1
H2(g)+1/2O2(g)===H2O(g)ΔH2=-241.7kJ·mol-1
H2(g)+1/2O2(g)===H2O(l)ΔH3=-285.8kJ·mol-1
下列说法正确的是
A.C(s)+H2O(g)===CO(g)+H2(g)ΔH=-131.2kJ·mol-1
B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1
C.2H2O(g)===2H2(g)+O2(g)ΔH=-483.4kJ·mol-1
D.H2O(g)===H2O(l)ΔH=-44.1kJ·mol-1
-
(1)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得),若1 mol水蒸气转化为液态水放出的热量为45kJ,则反应H2(g) + O2(g) = H2O( l )的ΔH =________________kJ/mol。
O2(g) = H2O( l )的ΔH =________________kJ/mol。
(2)下图为氢氧燃料电池的结构示意图,当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
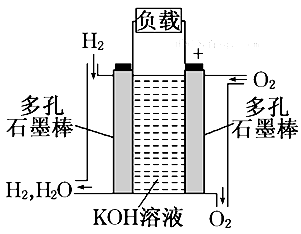
①图中通过负载的电子流动方向_______ (填“向左”或“向右”). 负极发生_____________反应;
②写出氢氧燃料电池工作时电极反应式负极:________________________________,正极:___________________________。
-
在101 kPa和25℃时,有反应的热化学方程式:
H2(g) + 1/2O2(g) =H2O(g) △H=-241.8kJ/mol,
H2(g) + 1/2O2(g) =H2O(1) △H=-285.8kJ/mol下列说法中错误的是
A.H2燃烧生成1mol H2O (g)时,放出241.8 kJ的热量
B.H2的燃烧热为-285.8 kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
-
(8分)按要求写出298K、101 kPa时下列反应的热化学方程式:
(1)3mol NO2(g)与1 mol H2O(1)反应生成HNO3(aq)和NO(g),放热138kJ:____________。
(2)1 mol HgO(s)分解为液态汞和氧气,吸热90.7kJ:___________________。
(3)①下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。

②写出表示丙烷燃烧热的热化学方程式:_______________________________________。
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
表示参加反应的O2的分子数目
mol O2所具有的总能量大于1mol H2O(g)所具有的总能量

